Unión química sin carga: Enlace covalente no polar
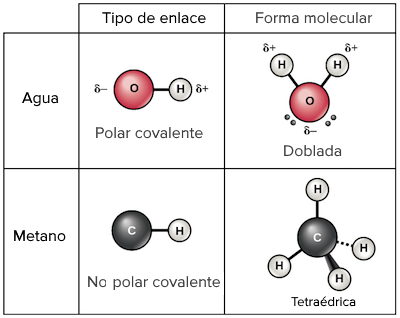
Cuando dos átomos se unen para formar una molécula, pueden hacerlo de diferentes maneras. Una de ellas es mediante un enlace covalente, en el que comparten electrones para estabilizarse. Dependiendo de cómo se compartan esos electrones, la unión puede ser polar o no polar. En este artículo, nos enfocaremos en la unión química sin carga: el enlace covalente no polar.
¿Qué es un enlace covalente no polar?
Los enlaces covalentes no polares son aquellos en los que los átomos comparten electrones de manera equitativa. Es decir, los átomos involucrados tienen la misma electronegatividad, lo que significa que tienen la misma capacidad para atraer electrones hacia ellos. Por lo tanto, no hay una separación significativa de cargas eléctricas en la molécula resultante.
¿Cómo se forma un enlace covalente no polar?
Para que se forme un enlace covalente no polar, es necesario que los átomos involucrados tengan la misma electronegatividad. Esto significa que tienen la misma capacidad para atraer electrones hacia ellos. Como resultado, los electrones de la capa externa de cada átomo se comparten de manera equitativa, formando un enlace covalente no polar.
Por ejemplo, el enlace entre dos átomos de hidrógeno (H) es un enlace covalente no polar, ya que ambos tienen la misma electronegatividad. Los dos electrones de la capa externa de cada átomo se comparten de manera equitativa, formando una molécula de gas hidrógeno (H2).
Características de un enlace covalente no polar
Los enlaces covalentes no polares tienen algunas características distintivas, que los hacen diferentes de otros tipos de enlaces químicos. Algunas de estas características son:
- Los átomos involucrados tienen la misma electronegatividad.
- Los electrones se comparten de manera equitativa.
- No hay una separación significativa de cargas eléctricas en la molécula resultante.
- Son relativamente débiles en comparación con los enlaces covalentes polares o iónicos.
- Pueden ser solubles en solventes no polares, como el benceno o el tetracloruro de carbono.
Ejemplos de enlaces covalentes no polares
Además del enlace entre dos átomos de hidrógeno (H2), hay muchos otros ejemplos de enlaces covalentes no polares en la naturaleza y la industria. Algunos de ellos son:
- El enlace entre dos átomos de oxígeno (O2).
- El enlace entre dos átomos de nitrógeno (N2).
- El enlace entre dos átomos de cloro (Cl2).
- El enlace entre dos átomos de flúor (F2).
- El enlace entre dos átomos de carbono en una molécula de etano (C2H6).
Usos de los enlaces covalentes no polares
Los enlaces covalentes no polares tienen varios usos importantes en la industria y la vida cotidiana. Por ejemplo:
- El gas hidrógeno (H2) se utiliza como combustible en motores de combustión interna y en la producción de amoníaco y otros productos químicos.
- El gas oxígeno (O2) se utiliza en la soldadura y corte de metales, y en la producción de productos químicos.
- El gas nitrógeno (N2) se utiliza en la producción de fertilizantes y otros productos químicos.
- El gas cloro (Cl2) se utiliza en la producción de productos químicos y en la purificación del agua.
- El gas etano (C2H6) se utiliza como combustible en estufas y calefones.
Conclusión
Los enlaces covalentes no polares son aquellos en los que los átomos comparten electrones de manera equitativa, sin una separación significativa de cargas eléctricas. Estos enlaces tienen varias características distintivas y se encuentran en muchas moléculas importantes para la industria y la vida cotidiana.
Preguntas frecuentes
1. ¿Qué es un enlace covalente?
Un enlace covalente es un tipo de enlace químico en el que dos átomos comparten electrones para estabilizarse.
2. ¿Qué es la electronegatividad?
La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en una molécula.
3. ¿Qué es un enlace covalente polar?
Un enlace covalente polar es aquel en el que los átomos involucrados tienen diferentes electronegatividades, lo que resulta en una separación de cargas eléctricas en la molécula resultante.
4. ¿Qué es un enlace iónico?
Un enlace iónico es un tipo de enlace químico en el que los átomos transfieren electrones para estabilizarse, formando iones cargados eléctricamente.
5. ¿Qué es la solubilidad?
La solubilidad es la capacidad de una sustancia para disolverse en un solvente dado, formando una solución homogénea.
Deja una respuesta