Titulación: Ácido débil vs. Base fuerte - Descubre su reacción
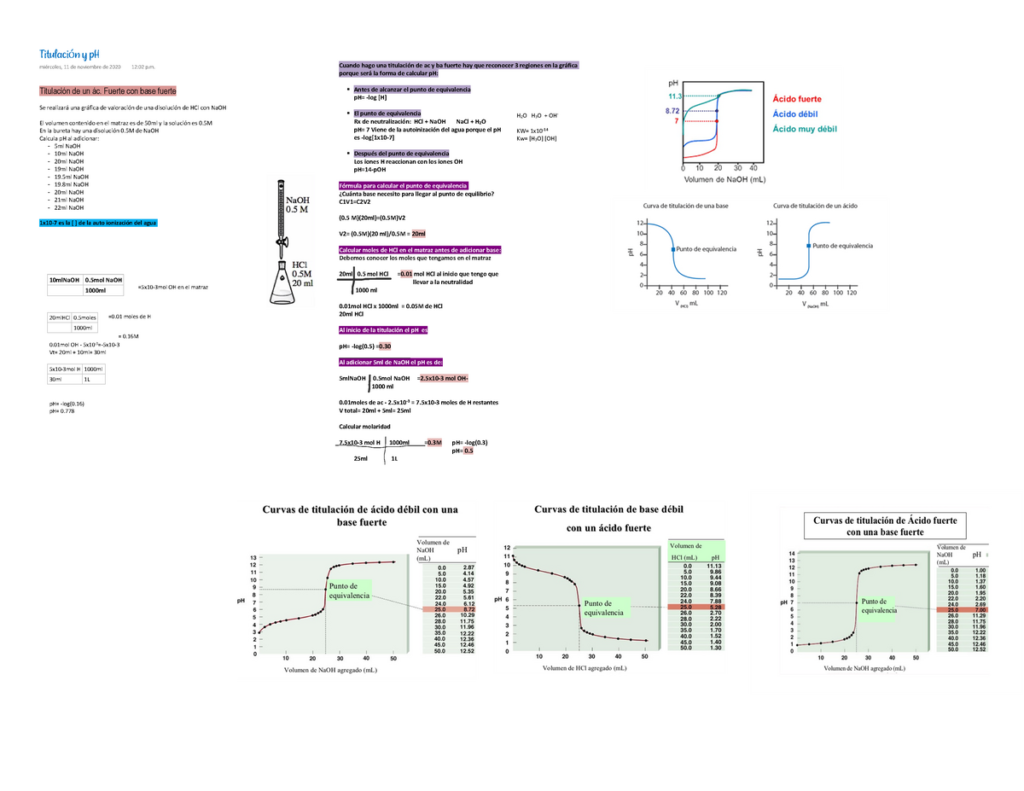
La titulación ácido-base es una técnica utilizada en química para determinar la concentración de una solución ácida o básica. Es un proceso químico que implica la reacción de un ácido con una base, y se utiliza para determinar la cantidad de ácido o base en una muestra desconocida. En este artículo, exploraremos la titulación de un ácido débil con una base fuerte y descubriremos cómo se produce su reacción.
¿Qué es un ácido débil?
Un ácido débil es un ácido que solo se disocia parcialmente en solución acuosa. Por ejemplo, el ácido acético es un ácido débil común. Cuando se disuelve en agua, solo una pequeña cantidad de moléculas de ácido se disocia en iones de hidrógeno y aniones acetato. La mayoría de las moléculas de ácido permanecen intactas en la solución.
¿Qué es una base fuerte?
Una base fuerte es una base que se disocia completamente en solución acuosa. Por ejemplo, el hidróxido de sodio es una base fuerte común. Cuando se disuelve en agua, todas las moléculas de base se disocian en iones hidróxido y cationes sodio. No quedan moléculas de base intactas en la solución.
¿Cómo ocurre la reacción?
Cuando se agrega una base fuerte a un ácido débil, se produce una reacción química conocida como neutralización. Durante la neutralización, los iones hidróxido de la base reaccionan con los iones hidrógeno del ácido. El resultado de esta reacción es la formación de agua y un compuesto iónico llamado sal.
Por ejemplo, si se agrega hidróxido de sodio a ácido acético, se produce la siguiente reacción:
CH3COOH + NaOH -> CH3COONa + H2O
En esta reacción, los iones hidróxido de la base (NaOH) reaccionan con los iones hidrógeno del ácido (CH3COOH) para formar agua (H2O) y la sal acetato de sodio (CH3COONa).
¿Cómo se lleva a cabo la titulación?
La titulación de un ácido débil con una base fuerte se lleva a cabo agregando la base fuerte a la solución de ácido débil en incrementos pequeños y controlados. Después de cada adición, se mide el pH de la solución. El pH es una medida de la acidez o basicidad de una solución, y se puede medir con un medidor de pH.
Cuando se agrega la base, el pH de la solución aumenta gradualmente. En algún momento, se alcanza un punto en el que la cantidad de base agregada es suficiente para neutralizar completamente el ácido. En este punto, el pH de la solución cambia abruptamente, lo que se conoce como punto de equivalencia. El punto de equivalencia indica que se ha agregado la cantidad correcta de base para neutralizar completamente el ácido.
¿Qué es un indicador ácido-base?
Para determinar con precisión el punto de equivalencia durante la titulación, se utiliza un indicador ácido-base. Un indicador ácido-base es una sustancia que cambia de color en respuesta a cambios en el pH de una solución. Por ejemplo, el indicador fenolftaleína es incoloro en soluciones ácidas y se vuelve rosa en soluciones básicas. Durante la titulación, se agrega el indicador a la solución de ácido débil y se observa el cambio de color para determinar cuándo se alcanza el punto de equivalencia.
¿Qué ocurre después del punto de equivalencia?
Después del punto de equivalencia, si se sigue agregando la base, el pH de la solución seguirá aumentando. En este punto, la solución se vuelve básica y se produce una sobretitulación. La sobretitulación puede ser problemática si se desea una solución ácida, ya que la cantidad excesiva de base agregada puede hacer que la solución sea demasiado básica.
Conclusión
La titulación de un ácido débil con una base fuerte es una técnica importante utilizada en química para determinar la concentración de una solución ácida o básica. Durante la titulación, se agrega la base fuerte en incrementos controlados y se mide el pH de la solución para determinar el punto de equivalencia. La adición de la base produce una reacción química conocida como neutralización, que resulta en la formación de agua y una sal.
Preguntas frecuentes
¿Qué es un ácido débil?
Un ácido débil es un ácido que solo se disocia parcialmente en solución acuosa.
¿Qué es una base fuerte?
Una base fuerte es una base que se disocia completamente en solución acuosa.
¿Qué es el punto de equivalencia?
El punto de equivalencia es el punto durante la titulación en el que se ha agregado la cantidad correcta de base para neutralizar completamente el ácido.
¿Qué es un indicador ácido-base?
Un indicador ácido-base es una sustancia que cambia de color en respuesta a cambios en el pH de una solución.
¿Qué es la sobretitulación?
La sobretitulación es el exceso de base agregada después del punto de equivalencia, lo que puede hacer que la solución sea demasiado básica.
Deja una respuesta