Presión de gas constante: ¡Descubre su relación con el volumen!
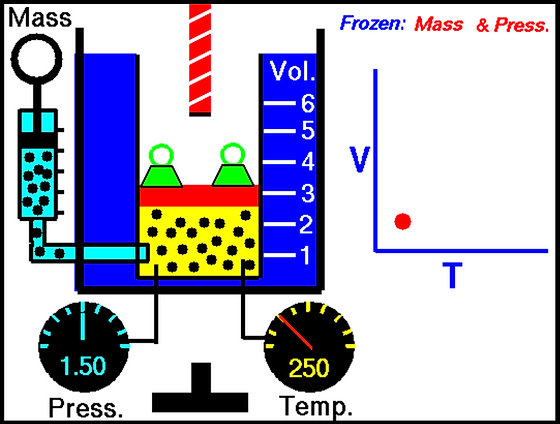
Si alguna vez has estudiado física o química, es probable que hayas escuchado hablar de la famosa ecuación de estado de los gases ideales: PV = nRT. Esta ecuación establece una relación entre la presión (P), el volumen (V), la cantidad de sustancia (n) y la temperatura (T) de un gas. Pero hoy nos centraremos en una situación en la que la presión es constante, lo que nos lleva a descubrir la relación entre la presión de gas constante y el volumen.
¿Qué es la presión de gas constante?
Antes de profundizar en la relación entre la presión de gas constante y el volumen, es importante entender qué es la presión de gas constante. Como su nombre indica, la presión de gas constante es aquella que permanece constante en un sistema de gas, independientemente de los cambios que puedan ocurrir en otros parámetros como el volumen o la temperatura.
La presión de gas constante es una de las condiciones ideales que se utilizan en la ley de Boyle-Mariotte, que establece que la presión de un gas es inversamente proporcional a su volumen (P ∝ 1/V) cuando la cantidad de gas y la temperatura permanecen constantes.
¿Cómo se relaciona la presión de gas constante con el volumen?
Ahora que sabemos qué es la presión de gas constante, es hora de explorar su relación con el volumen. Como mencionamos anteriormente, la ley de Boyle-Mariotte establece que la presión y el volumen de un gas son inversamente proporcionales cuando la cantidad de gas y la temperatura permanecen constantes.
Esto significa que, si la presión de un gas se mantiene constante, su volumen cambiará en proporción inversa a la presión. Es decir, si la presión se duplica, el volumen del gas se reducirá a la mitad. Por otro lado, si la presión se reduce a la mitad, el volumen del gas se duplicará.
¿Qué aplicaciones tiene la relación entre la presión de gas constante y el volumen?
La relación entre la presión de gas constante y el volumen tiene múltiples aplicaciones en la vida cotidiana y en la ciencia. Algunos ejemplos incluyen:
- En la elaboración de bebidas gaseosas, donde se utiliza la presión para disolver el gas en el líquido. Al reducir la presión, el gas se liberará y las burbujas se formarán.
- En la medicina, donde la relación entre la presión y el volumen se utiliza en la ventilación mecánica para ayudar a los pacientes con problemas respiratorios.
- En la industria petrolera, donde se utilizan equipos de perforación que generan grandes presiones para extraer el petróleo y el gas natural.
¿Cuáles son las leyes de los gases?
Además de la ley de Boyle-Mariotte, existen otras leyes de los gases que establecen relaciones entre los diferentes parámetros de un gas. Estas son:
- La ley de Charles: establece que, a presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta (V ∝ T).
- La ley de Gay-Lussac: establece que, a volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta (P ∝ T).
- La ley de Avogadro: establece que, a temperatura y presión constantes, el volumen de un gas es directamente proporcional a la cantidad de moléculas presentes (V ∝ n).
- La ecuación de estado de los gases ideales: establece una relación entre la presión, el volumen, la cantidad de sustancia y la temperatura de un gas (PV = nRT).
Conclusión
La relación entre la presión de gas constante y el volumen es una de las leyes fundamentales de los gases. La ley de Boyle-Mariotte establece que, a temperatura constante, la presión y el volumen de un gas son inversamente proporcionales. Esto significa que, si la presión de un gas se mantiene constante, su volumen cambiará en proporción inversa a la presión. Esta relación tiene múltiples aplicaciones en la vida cotidiana y en la ciencia.
Preguntas frecuentes
1. ¿Cómo afecta la temperatura a la relación entre la presión de gas constante y el volumen?
R: La relación entre la presión y el volumen de un gas solo es válida si la temperatura permanece constante. Si la temperatura cambia, se debe utilizar otra ley de los gases para establecer la relación entre los parámetros.
2. ¿Qué es la ley de Boyle-Mariotte?
R: La ley de Boyle-Mariotte establece que la presión y el volumen de un gas son inversamente proporcionales cuando la cantidad de gas y la temperatura permanecen constantes.
3. ¿Por qué se utilizan las leyes de los gases en la industria petrolera?
R: En la industria petrolera se utilizan equipos de perforación que generan grandes presiones para extraer el petróleo y el gas natural. El conocimiento de las leyes de los gases es fundamental para entender y controlar estos procesos.
4. ¿Qué es la ecuación de estado de los gases ideales?
R: La ecuación de estado de los gases ideales establece una relación entre la presión, el volumen, la cantidad de sustancia y la temperatura de un gas (PV = nRT).
5. ¿Cuál es la importancia de la relación entre la presión de gas constante y el volumen?
R: La relación entre la presión de gas constante y el volumen tiene múltiples aplicaciones en la vida cotidiana y en la ciencia, desde la elaboración de bebidas gaseosas hasta la ventilación mecánica en medicina. Además, es una de las leyes fundamentales de los gases que ayuda a entender y controlar procesos importantes en la industria y la investigación científica.
Deja una respuesta