Metales en la tabla periódica: características y ubicación
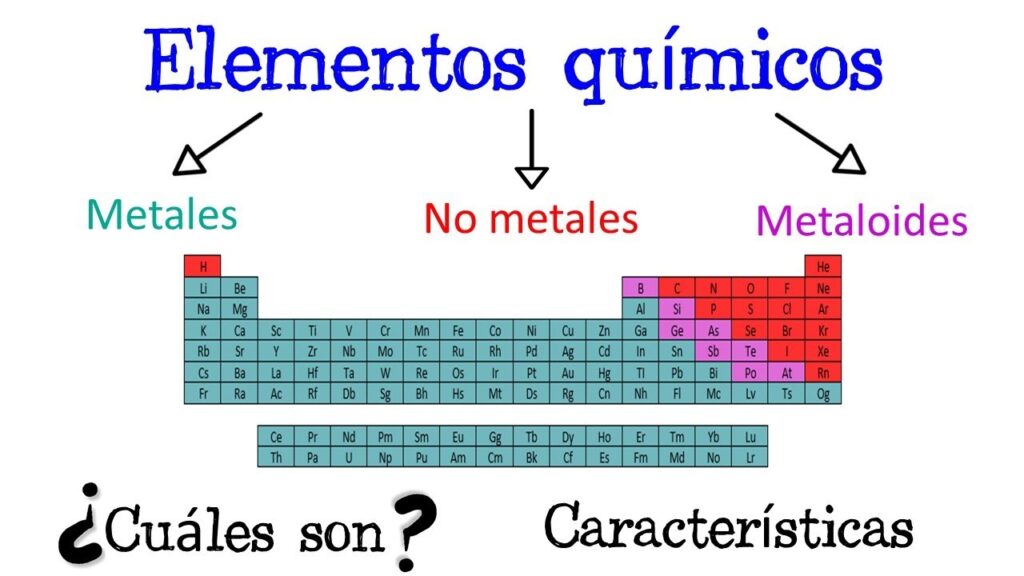
La tabla periódica es una herramienta muy útil para entender la química y la física de los elementos. En ella, los elementos se organizan en filas y columnas basándose en su estructura atómica y propiedades químicas y físicas. Uno de los grupos más importantes en la tabla periódica es el grupo de los metales.
¿Qué son los metales?
Los metales son elementos químicos que tienen ciertas características comunes. En general, son buenos conductores de electricidad y calor, son maleables y dúctiles (es decir, pueden ser moldeados en diferentes formas sin romperse), y tienen un brillo característico. Además, muchos metales son sólidos a temperatura ambiente, aunque algunos, como el mercurio, son líquidos.
Ubicación de los metales en la tabla periódica
Los metales se ubican en la parte izquierda y central de la tabla periódica. En la tabla periódica moderna, se encuentran en los grupos 1, 2 y 3 (excepto el hidrógeno), y en los grupos del 11 al 16. Los metales también se encuentran en el bloque d de la tabla, que se encuentra en el medio de la tabla periódica.
Características de los metales en la tabla periódica
Los metales tienen varias características que los hacen únicos en la tabla periódica. Algunas de estas características incluyen:
- Buena conductividad eléctrica y térmica: los metales son buenos conductores de electricidad y calor, lo que significa que pueden transferir fácilmente energía de un lugar a otro. Esto se debe a la estructura de los átomos de los metales, que tienen electrones libres que pueden moverse fácilmente.
- Maleabilidad y ductilidad: los metales pueden ser moldeados en diferentes formas sin romperse o perder sus propiedades. Esto se debe a la forma en que los átomos de los metales están unidos entre sí, lo que les da una estructura sólida y flexible.
- Brillo metálico: los metales tienen un brillo característico que se debe a la forma en que reflejan la luz. Este brillo se llama brillo metálico.
- Alta densidad: muchos metales son muy densos, lo que significa que tienen una gran cantidad de masa en un volumen relativamente pequeño.
- Reactividad química variable: los metales pueden reaccionar con otros elementos y compuestos de diferentes maneras, dependiendo de su posición en la tabla periódica y de las condiciones en las que se encuentren.
Ejemplos de metales en la tabla periódica
Algunos ejemplos de metales en la tabla periódica incluyen:
- Hierro (Fe): un metal común que se utiliza en la fabricación de acero y otros productos.
- Cobre (Cu): un metal que se utiliza en la fabricación de cables eléctricos y otros productos.
- Plata (Ag): un metal precioso que se utiliza en joyería y otros productos.
- Oro (Au): otro metal precioso que se utiliza en joyería y en la fabricación de electrónica y otros productos.
- Aluminio (Al): un metal ligero y resistente que se utiliza en la fabricación de latas de refresco, aviones y otros productos.
Conclusión
Los metales son elementos químicos importantes que tienen una amplia variedad de usos en la vida cotidiana y en la industria. Su ubicación en la tabla periódica y sus características únicas los hacen útiles y versátiles en una variedad de aplicaciones. Al entender la química y la física de los metales, podemos utilizarlos de manera más efectiva y responsable.
Preguntas frecuentes
1. ¿Por qué los metales son buenos conductores de electricidad?
Los metales son buenos conductores de electricidad porque tienen electrones libres que pueden moverse fácilmente de un átomo a otro. Esto significa que los electrones pueden transportar cargas eléctricas a través del metal de manera eficiente.
2. ¿Por qué algunos metales son más densos que otros?
La densidad de un metal depende de su masa y volumen. Algunos metales tienen una mayor masa por unidad de volumen que otros, lo que los hace más densos. Esto puede deberse a la estructura de los átomos de los metales y a la forma en que están unidos entre sí.
3. ¿Por qué algunos metales son más reactivos que otros?
La reactividad de un metal depende de su posición en la tabla periódica y de su estructura atómica. Algunos metales tienen una mayor afinidad por los electrones, lo que los hace más reactivos. Otros metales tienen electrones de valencia más estables, lo que los hace menos reactivos.
4. ¿Por qué algunos metales tienen un brillo metálico?
El brillo metálico se debe a la forma en que los metales reflejan la luz. Los electrones libres en los metales pueden absorber y reemitir la luz, lo que les da su característico brillo.
5. ¿Por qué los metales son maleables?
Los metales son maleables porque tienen una estructura cristalina que les permite deformarse sin romperse. Los átomos de los metales están unidos entre sí por enlaces metálicos, que son lo suficientemente débiles como para permitir que los átomos se desplacen unos sobre otros sin romperse.
Deja una respuesta