Masa atómica y número de masa: ¡Descubre su igualdad!
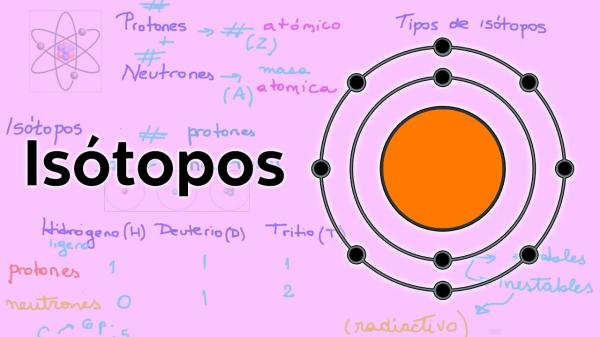
La masa atómica y el número de masa son dos conceptos muy importantes en el mundo de la química. Ambos términos están relacionados con la estructura de los átomos y su composición. Aunque son similares, la masa atómica y el número de masa tienen algunas diferencias clave que es importante entender. En este artículo, vamos a explorar la relación entre estos dos conceptos y cómo su igualdad nos ayuda a entender mejor la estructura atómica.
- ¿Qué es la masa atómica?
- ¿Qué es el número de masa?
- La igualdad entre masa atómica y número de masa
- ¿Por qué es importante la igualdad entre masa atómica y número de masa?
- Preguntas frecuentes
- ¿Por qué la masa atómica se representa como un rango?
- ¿Por qué los electrones no se incluyen en el cálculo de la masa atómica?
- ¿Por qué el número de masa se representa como un número entero?
- ¿Cómo se relaciona la masa atómica con la masa molecular?
- ¿Por qué es importante entender la relación entre masa atómica y número de masa?
¿Qué es la masa atómica?
La masa atómica es la masa de un átomo de un elemento en particular. Se mide en unidades de masa atómica (uma) y se calcula sumando la masa de los protones y neutrones en el núcleo del átomo. Los electrones no se incluyen en este cálculo porque su masa es tan pequeña que no afecta significativamente la masa total del átomo.
Por ejemplo, el átomo de carbono tiene seis protones y seis neutrones en su núcleo. La suma de estas masas es de aproximadamente 12 uma, por lo que la masa atómica del carbono es de 12 uma.
Es importante destacar que la masa atómica puede variar ligeramente debido a la existencia de isótopos en un elemento. Los isótopos son átomos del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Debido a esto, la masa atómica se representa a menudo como un rango en lugar de un número exacto.
¿Qué es el número de masa?
El número de masa, por otro lado, es la suma del número de protones y neutrones en el núcleo de un átomo. A diferencia de la masa atómica, el número de masa se representa como un número entero. Por lo tanto, el número de masa del átomo de carbono es 12, ya que tiene seis protones y seis neutrones.
La igualdad entre masa atómica y número de masa
Ahora es donde las cosas se ponen interesantes. La masa atómica y el número de masa son iguales en los átomos neutros de cualquier elemento. En otras palabras, si conoces el número de masa de un átomo, también puedes conocer su masa atómica. Y viceversa, si conoces la masa atómica de un átomo, también puedes conocer su número de masa.
Esto se debe a que la carga eléctrica de un átomo neutro es cero. Como los protones tienen una carga positiva y los electrones tienen una carga negativa, un átomo neutro debe tener el mismo número de protones y electrones. Por lo tanto, si sabemos el número de protones en un átomo, también sabemos el número de electrones.
El número de neutrones en un átomo neutro se puede calcular restando el número de protones del número de masa. Si conocemos tanto el número de protones como el número de neutrones, podemos calcular la masa atómica.
¿Por qué es importante la igualdad entre masa atómica y número de masa?
Esta igualdad es importante porque nos ayuda a entender mejor la estructura atómica y las propiedades de los elementos. Por ejemplo, si sabemos la masa atómica de un elemento, podemos calcular su densidad y su punto de fusión y ebullición. También podemos usar la masa atómica para calcular la cantidad de un elemento que se necesita en una reacción química.
Además, la igualdad entre masa atómica y número de masa es un ejemplo de cómo la naturaleza busca simplificar las cosas. Al igual que con la igualdad entre energía y masa en la famosa ecuación de Einstein, E=mc², la igualdad entre masa atómica y número de masa muestra cómo dos conceptos diferentes están en realidad relacionados de una manera simple y elegante.
Preguntas frecuentes
¿Por qué la masa atómica se representa como un rango?
La masa atómica se representa a menudo como un rango porque algunos elementos tienen isótopos con diferentes masas. Por ejemplo, el carbono tiene dos isótopos principales: el carbono-12 y el carbono-13. El carbono-12 es mucho más común que el carbono-13, por lo que la masa atómica del carbono se da como un rango entre 12.0096 y 12.0116 uma.
¿Por qué los electrones no se incluyen en el cálculo de la masa atómica?
Los electrones tienen una masa extremadamente pequeña en comparación con los protones y los neutrones. La masa de un electrón es de sólo 0,0005 uma, lo que es insignificante en comparación con la masa de un protón o un neutrón (aproximadamente 1 uma cada uno). Por lo tanto, los electrones no se incluyen en el cálculo de la masa atómica.
¿Por qué el número de masa se representa como un número entero?
El número de masa se representa como un número entero porque los protones y los neutrones tienen masas que son muy cercanas a números enteros. Por ejemplo, la masa de un protón es de aproximadamente 1 uma, mientras que la masa de un neutrón es de aproximadamente 1,008 uma. Por lo tanto, la suma de los protones y los neutrones en el núcleo de un átomo se aproxima a un número entero.
¿Cómo se relaciona la masa atómica con la masa molecular?
La masa atómica se refiere a la masa de un solo átomo, mientras que la masa molecular se refiere a la masa de una molécula compuesta por varios átomos. La masa molecular se calcula sumando las masas atómicas de todos los átomos en la molécula.
¿Por qué es importante entender la relación entre masa atómica y número de masa?
Entender la relación entre masa atómica y número de masa es importante porque nos ayuda a entender mejor las propiedades y comportamientos de los elementos. También nos permite hacer cálculos precisos en la química y otras áreas de la ciencia. Además, la igualdad entre masa atómica y número de masa es un ejemplo de cómo la naturaleza busca simplificar las cosas, lo que puede ser fascinante para los científicos y los curiosos por igual.
Deja una respuesta