Masa atómica elemental: todo lo que necesitas saber
- ¿Qué es la masa atómica elemental?
- ¿Cómo se determina la masa atómica elemental?
- ¿Por qué es importante la masa atómica elemental?
- ¿Cómo se relaciona la masa atómica con el número atómico?
- ¿Cómo se relaciona la masa atómica con la masa molecular?
- ¿Qué es la masa atómica media?
- ¿Cómo se utiliza la masa atómica en la vida cotidiana?
- ¿Cómo se mide la masa atómica?
- ¿Qué es la masa atómica relativa?
- ¿Cómo se relaciona la masa atómica con la energía nuclear?
- ¿Cómo influye la masa atómica en la reactividad química?
- ¿Cómo se relaciona la masa atómica con la densidad de un elemento?
- ¿Cómo se relaciona la masa atómica con la temperatura de fusión y ebullición?
- ¿Cómo se relaciona la masa atómica con la conductividad eléctrica?
- Conclusión
- Preguntas frecuentes
¿Qué es la masa atómica elemental?
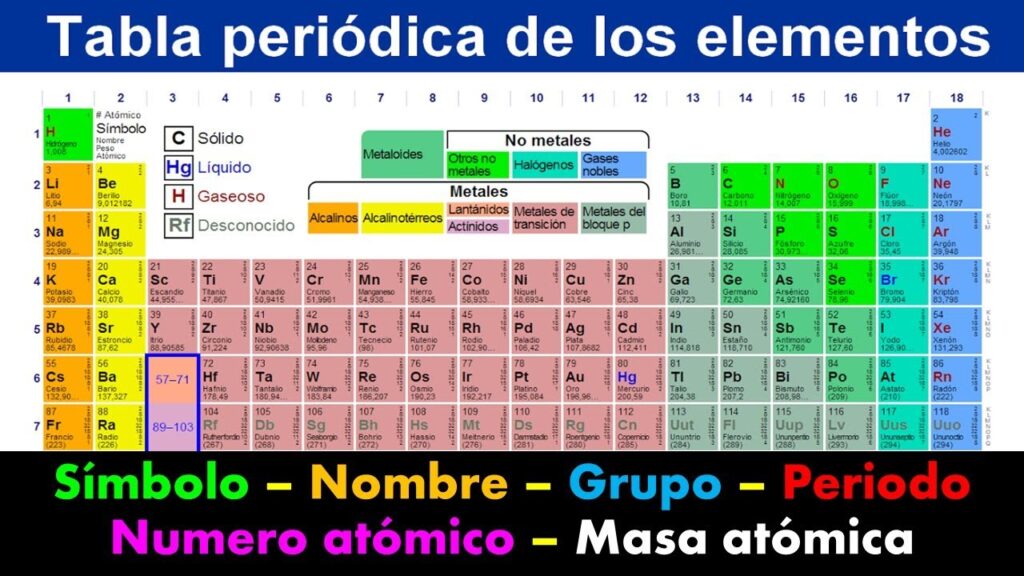
La masa atómica elemental es la masa de un átomo de un elemento químico en particular. Se mide en unidades de masa atómica (u), que es aproximadamente igual a la masa de un protón o un neutrón. La masa atómica se encuentra en la tabla periódica, debajo del símbolo del elemento.
¿Cómo se determina la masa atómica elemental?
La masa atómica elemental se determina utilizando la masa y la abundancia de cada isótopo del elemento. Un isótopo es un átomo del mismo elemento con un número diferente de neutrones en su núcleo. La masa atómica se calcula multiplicando la masa de cada isótopo por su abundancia y sumando los resultados.
¿Por qué es importante la masa atómica elemental?
La masa atómica elemental es importante porque se utiliza en cálculos químicos y físicos. Por ejemplo, se utiliza para calcular la masa molecular de un compuesto químico, que es la suma de las masas atómicas de los átomos que componen el compuesto. También se utiliza para determinar la cantidad de material que se necesita para una reacción química específica.
¿Cómo se relaciona la masa atómica con el número atómico?
El número atómico de un elemento es el número de protones en el núcleo de un átomo de ese elemento. La masa atómica, por otro lado, es la suma de la masa de los protones y neutrones en el núcleo de un átomo. Como todos los átomos de un elemento tienen el mismo número de protones, el número atómico también se utiliza para identificar el elemento. La masa atómica puede variar debido a la presencia de diferentes isótopos.
¿Cómo se relaciona la masa atómica con la masa molecular?
La masa molecular de un compuesto químico es la suma de las masas atómicas de todos los átomos en la molécula. Por ejemplo, la masa molecular del agua (H2O) es igual a la masa atómica del hidrógeno (1 u) multiplicada por dos y sumada a la masa atómica del oxígeno (16 u). La masa molecular del agua es igual a 18 u.
¿Qué es la masa atómica media?
La masa atómica media es la masa promedio de todos los isótopos de un elemento. Se utiliza en cálculos químicos y se encuentra en la tabla periódica, debajo del símbolo del elemento. La masa atómica media se calcula utilizando las masas atómicas de todos los isótopos y sus abundancias relativas.
¿Cómo se utiliza la masa atómica en la vida cotidiana?
La masa atómica se utiliza en la vida cotidiana en una variedad de formas. Por ejemplo, se utiliza para determinar la cantidad de medicamento que se necesita para una dosis específica. También se utiliza en la industria alimentaria para determinar la cantidad de nutrientes en los alimentos y en la industria de la energía nuclear para calcular la cantidad de energía que se puede obtener de una reacción nuclear.
¿Cómo se mide la masa atómica?
La masa atómica se mide utilizando un espectrómetro de masas. Un espectrómetro de masas mide la relación entre la carga y la masa de un ion, lo que permite la identificación y medición de la masa de los isótopos de un elemento.
¿Qué es la masa atómica relativa?
La masa atómica relativa es la masa de un átomo en comparación con la masa de un átomo de carbono-12, que se define como 12 u. La masa atómica relativa se encuentra en la tabla periódica y se utiliza en cálculos químicos.
¿Cómo se relaciona la masa atómica con la energía nuclear?
La masa atómica está relacionada con la energía nuclear porque la energía puede ser liberada o absorbida durante una reacción nuclear debido a un cambio en la masa atómica. La ecuación E=mc^2, propuesta por Albert Einstein, muestra la relación entre la masa y la energía. La energía (E) es igual a la masa (m) multiplicada por la velocidad de la luz al cuadrado (c^2).
¿Cómo influye la masa atómica en la reactividad química?
La masa atómica puede influir en la reactividad química porque los átomos más pesados tienen más protones y electrones que los átomos más ligeros. Esto puede afectar la forma en que los átomos interactúan con otros átomos y moléculas durante una reacción química.
¿Cómo se relaciona la masa atómica con la densidad de un elemento?
La masa atómica puede influir en la densidad de un elemento porque la densidad es la masa de un objeto dividida por su volumen. Si un elemento tiene una masa atómica alta, significa que sus átomos son más pesados, lo que puede aumentar su densidad.
¿Cómo se relaciona la masa atómica con la temperatura de fusión y ebullición?
La masa atómica puede influir en la temperatura de fusión y ebullición de un elemento porque la fuerza de las fuerzas intermoleculares depende de la masa de los átomos. Si un elemento tiene átomos más pesados, puede tener una temperatura de fusión y ebullición más alta ya que las fuerzas intermoleculares son más fuertes.
¿Cómo se relaciona la masa atómica con la conductividad eléctrica?
La masa atómica no tiene una relación directa con la conductividad eléctrica. Sin embargo, la conductividad eléctrica puede verse afectada por la estructura electrónica de un átomo y la forma en que los electrones se mueven a través de ella.
Conclusión
La masa atómica elemental es un concepto importante en la química y la física. Se utiliza en una variedad de cálculos y se encuentra en la tabla periódica. La masa atómica se determina utilizando la masa y la abundancia de los isótopos de un elemento y puede influir en la reactividad química, la densidad y la temperatura de fusión y ebullición de un elemento.
Preguntas frecuentes
1. ¿Cómo se relaciona la masa atómica con la masa molecular?
La masa molecular es la suma de las masas atómicas de todos los átomos en una molécula. La masa atómica se utiliza para calcular la masa molecular de un compuesto químico.
2. ¿Cómo se mide la masa atómica?
La masa atómica se mide utilizando un espectrómetro de masas, que mide la relación entre la carga y la masa de un ion.
3. ¿Por qué es importante la masa atómica?
La masa atómica es importante porque se utiliza en cálculos químicos y físicos, como la
Deja una respuesta