La evolución de los modelos atómicos: de Demócrito a Schrödinger
Desde la antigua Grecia hasta nuestros días, el estudio de la estructura de la materia ha sido de gran interés para científicos y filósofos por igual. Uno de los mayores avances en este campo se dio con la creación de los modelos atómicos, los cuales han evolucionado a lo largo de los siglos.
- Modelo atómico de Demócrito
- Modelo atómico de Dalton
- Modelo atómico de Thomson
- Modelo atómico de Rutherford
- Modelo atómico de Bohr
- Modelo atómico de Schrödinger
- Conclusión
- Preguntas frecuentes
- 1. ¿Cuál fue el primer modelo atómico propuesto?
- 2. ¿Qué descubrimiento permitió a Thomson proponer su modelo atómico?
- 3. ¿Cuál fue el modelo atómico que incluyó la noción de partículas subatómicas?
- 4. ¿Qué descubrimiento llevó a Rutherford a proponer su modelo planetario?
- 5. ¿Qué modelo atómico se basa en la idea de que los electrones se encuentran en nubes de probabilidad?
Modelo atómico de Demócrito
En el año 460 a.C., el filósofo griego Demócrito propuso la idea de que la materia estaba compuesta por partículas indivisibles a las que llamó átomos. Según su teoría, los átomos eran eternos e indestructibles, y diferían entre sí en su forma, tamaño y posición en el espacio.
Sin embargo, su modelo carecía de evidencia experimental y no pudo ser comprobado hasta varios siglos después.
Modelo atómico de Dalton
A principios del siglo XIX, el químico británico John Dalton propuso un modelo atómico basado en la idea de que los átomos eran esferas sólidas e indivisibles. Según su teoría, los átomos se combinaban para formar compuestos químicos en proporciones fijas.
Este modelo tuvo un gran impacto en la química y sirvió como base para futuras investigaciones.
Modelo atómico de Thomson
En 1897, el físico británico J.J. Thomson descubrió el electrón, una partícula subatómica con carga negativa. Basándose en sus experimentos, propuso un modelo atómico en el que los electrones se encontraban incrustados en una esfera de carga positiva, como pasas en un pudín.
Este modelo fue conocido como el modelo del pudín de pasas y fue el primer modelo atómico que incluyó la noción de partículas subatómicas.
Modelo atómico de Rutherford
En 1911, el físico neozelandés Ernest Rutherford llevó a cabo un experimento en el que disparó partículas alfa contra una lámina de oro. Observó que algunas partículas eran desviadas en ángulos inesperados, lo que llevó a la conclusión de que los átomos contenían un núcleo central con carga positiva.
Este modelo atómico fue conocido como el modelo planetario y propuso que los electrones giraban alrededor del núcleo en órbitas circulares.
Modelo atómico de Bohr
En 1913, el físico danés Niels Bohr propuso un modelo atómico que combinaba los descubrimientos de Thomson y Rutherford. Según su teoría, los electrones giraban alrededor del núcleo en órbitas circulares, pero sólo en ciertas órbitas estables.
Este modelo permitió explicar por qué los átomos emitían radiación en espectros discretos y se convirtió en uno de los modelos atómicos más influyentes.
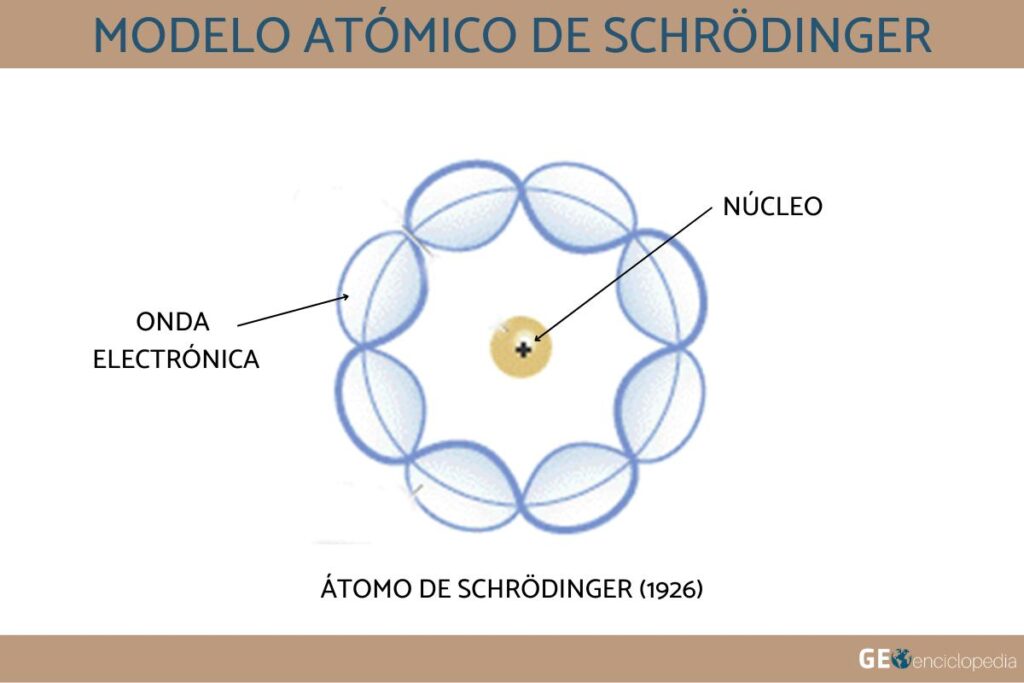
Modelo atómico de Schrödinger
En la década de 1920, el físico austriaco Erwin Schrödinger propuso una teoría que describía el comportamiento de los electrones en términos de ondas. Su modelo atómico se basaba en la idea de que los electrones se encontraban en nubes de probabilidad, en lugar de en órbitas circulares.
Este modelo permitió explicar la estructura de los átomos y moléculas más complejos, y se convirtió en la base de la mecánica cuántica.
Conclusión
La evolución de los modelos atómicos ha sido un proceso largo y complejo que ha involucrado a muchos científicos y teorías a lo largo de la historia. Cada modelo ha sido una mejora del anterior, y ha permitido una mejor comprensión de la estructura de la materia.
Preguntas frecuentes
1. ¿Cuál fue el primer modelo atómico propuesto?
El primer modelo atómico fue propuesto por Demócrito en el año 460 a.C.
2. ¿Qué descubrimiento permitió a Thomson proponer su modelo atómico?
Thomson descubrió el electrón, una partícula subatómica con carga negativa, lo que le permitió proponer su modelo del pudín de pasas.
3. ¿Cuál fue el modelo atómico que incluyó la noción de partículas subatómicas?
El modelo atómico de Thomson fue el primer modelo que incluyó la noción de partículas subatómicas.
4. ¿Qué descubrimiento llevó a Rutherford a proponer su modelo planetario?
Rutherford descubrió que los átomos contenían un núcleo central con carga positiva, lo que llevó a proponer su modelo planetario.
5. ¿Qué modelo atómico se basa en la idea de que los electrones se encuentran en nubes de probabilidad?
El modelo atómico de Schrödinger se basa en la idea de que los electrones se encuentran en nubes de probabilidad.
Deja una respuesta