La estructura de Lewis del cloruro de sodio: ¡descúbrela aquí!
Si eres estudiante de química, seguramente has oído hablar de la estructura de Lewis. Esta es una herramienta clave para entender cómo los átomos se unen para formar moléculas. En este artículo, te mostraremos la estructura de Lewis del cloruro de sodio (NaCl) y cómo se forma esta molécula.
¿Qué es la estructura de Lewis?
La estructura de Lewis es una representación visual de los electrones en una molécula. Cada átomo en una molécula tiene un número específico de electrones de valencia, es decir, electrones en su capa externa. Estos electrones son los que se utilizan para formar enlaces químicos.
En la estructura de Lewis, los electrones de valencia se representan con puntos alrededor del símbolo del átomo. Cada punto representa un electrón. Los enlaces químicos se representan con líneas que conectan los átomos.
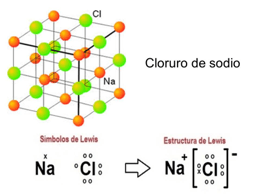
La estructura de Lewis del cloruro de sodio
El cloruro de sodio es una molécula compuesta por un átomo de sodio (Na) y un átomo de cloro (Cl). El sodio tiene un electrón de valencia y el cloro tiene siete electrones de valencia.
Para formar el cloruro de sodio, el sodio pierde su electrón de valencia y el cloro gana un electrón. Esto crea dos iones: un ion de sodio positivo (Na+) y un ion de cloro negativo (Cl-).
En la estructura de Lewis del cloruro de sodio, el átomo de sodio se representa con un punto y el átomo de cloro se representa con siete puntos. Se dibuja una línea entre los átomos para representar el enlace iónico entre ellos.
Cómo se forma el cloruro de sodio
El cloruro de sodio se forma a través de una reacción química entre el sodio y el cloro. Durante esta reacción, el sodio pierde su electrón de valencia y el cloro gana un electrón. Esto crea los iones de sodio y cloro que se unen para formar el cloruro de sodio.
La reacción química se puede escribir de la siguiente manera:
Na + Cl -> Na+ + Cl-
La reacción es altamente exotérmica, lo que significa que libera una gran cantidad de energía en forma de calor y luz.
Propiedades del cloruro de sodio
El cloruro de sodio es un compuesto cristalino blanco y sólido a temperatura ambiente. Es soluble en agua y su solución acuosa es conocida como agua salada o agua de mar.
El cloruro de sodio es un compuesto iónico, lo que significa que tiene una alta energía de enlace. Esto lo convierte en un compuesto muy estable y difícil de romper.
El cloruro de sodio también es un electrolito, lo que significa que puede conducir electricidad cuando se disuelve en agua. Esta propiedad es importante en muchas aplicaciones, como la electroquímica y la medicina.
Conclusion
La estructura de Lewis es una herramienta valiosa para entender cómo los átomos se unen para formar moléculas. En el caso del cloruro de sodio, la estructura de Lewis muestra cómo el sodio y el cloro se unen para formar un compuesto iónico estable.
El cloruro de sodio es un compuesto común que se encuentra en la naturaleza y tiene muchas aplicaciones prácticas. La comprensión de su estructura de Lewis puede ayudar a los estudiantes de química a comprender mejor cómo se forman y se comportan las moléculas.
Preguntas frecuentes
1. ¿Por qué el sodio pierde un electrón de valencia?
El sodio tiene un electrón de valencia en su capa externa y está altamente dispuesto a perderlo para alcanzar una configuración electrónica estable. Al perder su electrón, el sodio se convierte en un ion positivo y se une al ion de cloro negativo para formar el cloruro de sodio.
2. ¿Por qué el cloruro de sodio es un compuesto iónico?
El cloruro de sodio es un compuesto iónico porque tiene una alta energía de enlace entre los iones de sodio y cloro. Los iones tienen cargas opuestas y se atraen entre sí, formando un enlace iónico fuerte.
3. ¿Cuál es la fórmula química del cloruro de sodio?
La fórmula química del cloruro de sodio es NaCl.
4. ¿Por qué el cloruro de sodio es soluble en agua?
El cloruro de sodio es soluble en agua debido a su naturaleza iónica. Cuando se disuelve en agua, los iones de sodio y cloro se separan y se rodean de moléculas de agua, lo que permite que se disuelvan.
5. ¿Por qué el cloruro de sodio es un electrolito?
El cloruro de sodio es un electrolito porque se disocia en iones cuando se disuelve en agua y puede conducir electricidad. Los iones cargados positiva y negativamente permiten que la corriente eléctrica fluya a través de la solución.
Deja una respuesta