Grupo químico: propiedades similares entre elementos
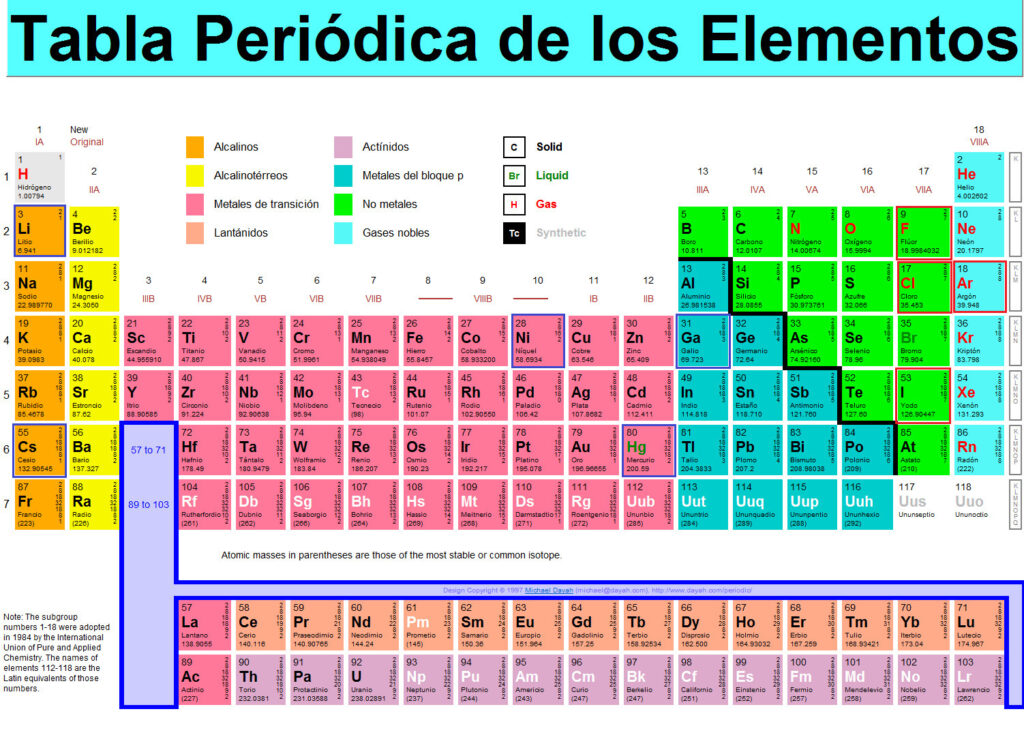
Cuando se estudia la tabla periódica, es común encontrar agrupaciones de elementos que comparten algunas características comunes. Estos grupos se denominan grupos químicos, y su organización ayuda a entender las propiedades de los elementos y su comportamiento en diversas reacciones químicas.
En general, los elementos que pertenecen a un grupo químico tienen la misma cantidad de electrones en su capa más externa, lo que se conoce como configuración electrónica. Esta similitud en la disposición de los electrones es la razón por la cual los elementos de un mismo grupo presentan propiedades químicas semejantes.
A continuación, se describen algunos de los grupos químicos más importantes y sus propiedades características:
Grupo 1: los metales alcalinos
Los elementos de este grupo son los metales más reactivos de la tabla periódica. Todos ellos tienen un solo electrón en su capa externa, lo que los hace altamente reactivos y propensos a formar iones positivos. Los metales alcalinos son muy blandos y tienen bajos puntos de fusión y ebullición.
Grupo 2: los metales alcalinotérreos
Los elementos de este grupo tienen dos electrones en su capa externa, lo que los hace menos reactivos que los metales alcalinos. Sin embargo, todavía son bastante reactivos y forman iones positivos con facilidad. Los metales alcalinotérreos son más duros y tienen puntos de fusión y ebullición más altos que los metales alcalinos.
Grupo 17: los halógenos
Los elementos de este grupo son los no metales más reactivos de la tabla periódica. Todos ellos tienen siete electrones en su capa externa, lo que los hace altamente reactivos y propensos a formar iones negativos. Los halógenos son gases o líquidos a temperatura ambiente y tienen puntos de fusión y ebullición bajos.
Grupo 18: los gases nobles
Los elementos de este grupo tienen una configuración electrónica muy estable, lo que los hace extremadamente no reactivos. Los gases nobles son gases a temperatura ambiente y tienen puntos de fusión y ebullición muy bajos. A pesar de su falta de reactividad, los gases nobles tienen una variedad de aplicaciones prácticas, como en la iluminación y la refrigeración.
Grupo 3-12: la serie de transición
Los elementos de esta serie tienen capas externas que contienen electrones d, lo que les da propiedades características como la formación de compuestos de coordinación y la capacidad de tener múltiples estados de oxidación. Los metales de transición son generalmente duros, resistentes y tienen puntos de fusión y ebullición altos.
Los grupos químicos son una herramienta importante para entender las propiedades de los elementos y cómo se comportan en las reacciones químicas. A través de la organización de la tabla periódica, es posible identificar patrones y similitudes entre los elementos de un mismo grupo, lo que permite hacer predicciones sobre su comportamiento en diferentes situaciones.
Preguntas frecuentes
1. ¿Por qué los elementos de un mismo grupo tienen propiedades químicas similares?
Los elementos de un mismo grupo tienen la misma cantidad de electrones en su capa más externa, lo que se conoce como configuración electrónica. Esta similitud en la disposición de los electrones es la razón por la cual los elementos de un mismo grupo presentan propiedades químicas semejantes.
2. ¿Cuáles son los grupos químicos más importantes?
Algunos de los grupos químicos más importantes son los metales alcalinos, los metales alcalinotérreos, los halógenos, los gases nobles y la serie de transición.
3. ¿Por qué los metales alcalinos son tan reactivos?
Los metales alcalinos tienen un solo electrón en su capa externa, lo que los hace altamente reactivos y propensos a formar iones positivos.
4. ¿Por qué los gases nobles son tan no reactivos?
Los gases nobles tienen una configuración electrónica muy estable, lo que los hace extremadamente no reactivos.
5. ¿Por qué los metales de transición tienen múltiples estados de oxidación?
Los metales de transición tienen capas externas que contienen electrones d, lo que les da propiedades características como la formación de compuestos de coordinación y la capacidad de tener múltiples estados de oxidación.
Deja una respuesta