Equilibrio termodinámico: cuando todo está en armonía
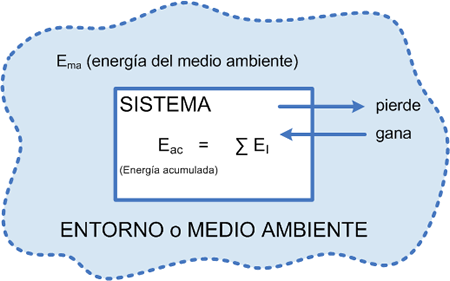
El equilibrio termodinámico es un concepto fundamental en la física y la química, que se refiere al estado en el que un sistema se encuentra en equilibrio térmico, mecánico y químico. En otras palabras, es el estado en el que todo está en armonía y no hay cambios significativos en las propiedades del sistema.
Para entender mejor el equilibrio termodinámico, podemos imaginar un vaso de agua lleno hasta la mitad. Si añadimos más agua, el nivel subirá hasta que el vaso esté lleno. A partir de ese momento, no importa cuánta agua añadamos, el nivel no subirá más. El sistema ha alcanzado el equilibrio, y cualquier cambio que se produzca (por ejemplo, si se añade sal al agua) será compensado por cambios opuestos en otras propiedades del sistema.
En la termodinámica, el equilibrio se define en función de tres variables: la temperatura, la presión y el potencial químico. Cuando estas variables están equilibradas, el sistema se encuentra en equilibrio termodinámico.
Existen varios tipos de equilibrio termodinámico, dependiendo de las variables que se equilibren. Algunos ejemplos son:
- Equilibrio térmico: cuando dos objetos a diferentes temperaturas se ponen en contacto, la energía térmica se transfiere del objeto más caliente al más frío hasta que ambos objetos alcanzan la misma temperatura.
- Equilibrio mecánico: si tenemos un gas confinado en un recipiente con un pistón móvil, el equilibrio mecánico se alcanza cuando la presión del gas es igual a la presión ejercida por el pistón.
- Equilibrio químico: este tipo de equilibrio se alcanza cuando las reacciones químicas en un sistema se producen a la misma velocidad en ambas direcciones. En otras palabras, la cantidad de reactivos y productos se mantiene constante.
El equilibrio termodinámico es importante porque nos permite predecir cómo se comportará un sistema en determinadas condiciones. Por ejemplo, si sabemos que un sistema está en equilibrio térmico, podemos predecir cómo cambiará su temperatura si le añadimos o le quitamos energía térmica. De la misma manera, si sabemos que un sistema está en equilibrio químico, podemos predecir cómo cambiará la cantidad de reactivos y productos si cambiamos las condiciones del sistema.
El equilibrio termodinámico es un estado de armonía en el que todas las variables se equilibran y no hay cambios significativos en las propiedades del sistema. Es un concepto fundamental en la física y la química, y nos permite predecir cómo se comportará un sistema en determinadas condiciones.
Las tres leyes de la termodinámica
Para entender mejor el equilibrio termodinámico, es importante conocer las tres leyes de la termodinámica. Estas leyes establecen los principios fundamentales que rigen el comportamiento de la energía en los sistemas físicos.
Primera ley de la termodinámica: conservación de la energía
La primera ley de la termodinámica establece que la energía no se crea ni se destruye, sino que se transforma de una forma a otra. En otras palabras, la energía total de un sistema cerrado es constante.
Esta ley es importante porque nos permite entender cómo la energía se mueve entre diferentes formas en un sistema. Por ejemplo, si tenemos un objeto en reposo en la cima de una montaña, la energía potencial gravitatoria del objeto se transformará en energía cinética a medida que el objeto se desplaza hacia abajo.
Segunda ley de la termodinámica: entropía
La segunda ley de la termodinámica establece que la entropía de un sistema cerrado siempre aumenta con el tiempo. La entropía es una medida del desorden o la aleatoriedad en un sistema.
Esta ley es importante porque nos permite entender por qué algunos procesos son irreversibles. Por ejemplo, si dejamos caer un huevo al suelo, la energía cinética del huevo se transforma en energía térmica al entrar en contacto con el suelo. La energía térmica se dispersa en el ambiente, aumentando la entropía del sistema. Este proceso es irreversible, ya que no podemos volver a juntar las piezas del huevo y hacer que vuelva a ser un huevo entero.
Tercera ley de la termodinámica: cero absoluto
La tercera ley de la termodinámica establece que es imposible alcanzar el cero absoluto de temperatura. El cero absoluto es la temperatura más baja posible, en la que las moléculas de un sistema no tienen energía cinética.
Esta ley es importante porque nos permite entender cómo se comportan los sistemas cuando se acercan al cero absoluto. Por ejemplo, a medida que se reduce la temperatura de un gas, su volumen disminuye y su presión aumenta. Cuando se alcanza el cero absoluto, el gas se convierte en un sólido.
El equilibrio termodinámico en la vida cotidiana
Aunque el equilibrio termodinámico es un concepto fundamental en la física y la química, también se puede observar en la vida cotidiana. Algunos ejemplos son:
- Cuando cocinamos alimentos en una olla, el agua del interior de la olla alcanza el equilibrio térmico con los alimentos y el fuego. Cuando la temperatura del agua alcanza el punto de ebullición, se mantiene constante hasta que todo el agua se evapora.
- Cuando llevamos una bebida caliente en una taza de cerámica, la taza alcanza el equilibrio térmico con la bebida. Si dejamos la taza en una mesa, la energía térmica de la bebida se transfiere a la taza y luego al ambiente. La taza se enfría hasta alcanzar la temperatura ambiente.
- Cuando mantenemos un equilibrio entre nuestra dieta y nuestro ejercicio físico, nuestro cuerpo alcanza un equilibrio energético. Si consumimos más calorías de las que gastamos, ganamos peso. Si gastamos más calorías de las que consumimos, perdemos peso.
Cómo se alcanza el equilibrio termodinámico
Para que un sistema alcance el equilibrio termodinámico, es necesario que se cumplan dos condiciones:
- El sistema debe estar cerrado, es decir, no debe haber intercambio de materia o energía con el exterior.
- Las variables termodinámicas del sistema (temperatura, presión, potencial químico, etc.) deben estar uniformes en todo el sistema.
Si se cumplen estas dos condiciones, el sistema alcanzará el equilibrio termodinámico. Sin embargo, este proceso puede llevar tiempo, dependiendo de las condiciones iniciales del sistema y de las propiedades del sistema.
Aplicaciones del equilibrio termodinámico
El equilibrio termodinámico tiene muchas aplicaciones prácticas en la ciencia y la tecnología. Algunos ejemplos son:
- En la industria química, el equilibrio qu
Deja una respuesta