Enlace químico: ¿Dónde ocurre en el átomo?
Cuando pensamos en átomos, a menudo imaginamos pequeñas esferas en movimiento que se unen para formar moléculas. Sin embargo, la realidad es mucho más complicada que eso. El enlace químico, que es lo que mantiene unidos a los átomos, ocurre en varias partes del átomo. En este artículo, exploraremos dónde ocurre el enlace químico en el átomo.
El núcleo del átomo
El núcleo del átomo es donde se encuentran los protones y los neutrones. Los protones tienen una carga positiva, mientras que los neutrones no tienen carga. El número de protones en el núcleo determina el elemento químico al que pertenece el átomo.
Aunque los protones tienen carga positiva, no se repelen entre sí debido a la presencia de los neutrones. Los neutrones actúan como una especie de pegamento que mantiene unidos a los protones. Este tipo de enlace se llama enlace nuclear.
La nube electrónica
La nube electrónica es el área alrededor del núcleo donde giran los electrones. Los electrones tienen carga negativa y se mantienen unidos al núcleo debido a la atracción electrostática.
La nube electrónica es donde ocurren la mayoría de los enlaces químicos. Los átomos comparten electrones o transfieren electrones para formar enlaces químicos. Estos enlaces pueden ser covalentes o iónicos.
Enlaces covalentes
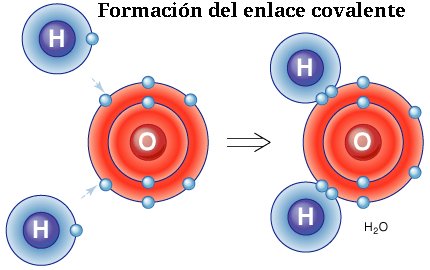
En un enlace covalente, los átomos comparten electrones en su nube electrónica. Esto ocurre cuando dos átomos tienen una electronegatividad similar, lo que significa que tienen una atracción similar por los electrones.
Un ejemplo de un enlace covalente ocurre en la molécula de agua. El átomo de oxígeno comparte electrones con dos átomos de hidrógeno para formar la molécula H2O.
Enlaces iónicos
En un enlace iónico, los átomos transfieren electrones entre sí. Esto ocurre cuando dos átomos tienen una diferencia significativa en su electronegatividad, lo que significa que uno tiene una atracción mucho mayor por los electrones que el otro.
Un ejemplo de un enlace iónico ocurre en la molécula de cloruro de sodio (sal de mesa). El átomo de sodio transfiere un electrón al átomo de cloro, lo que hace que el sodio tenga carga positiva y el cloro tenga carga negativa. Estas cargas opuestas hacen que los átomos se atraigan entre sí y formen la molécula de sal.
La capa de valencia
La capa de valencia es la capa más externa de electrones en un átomo. Es donde ocurren la mayoría de los enlaces químicos. Los átomos se unen con otros átomos para completar su capa de valencia y alcanzar la estabilidad.
Por ejemplo, el átomo de carbono tiene cuatro electrones en su capa de valencia. Para alcanzar la estabilidad, necesita ocho electrones en su capa de valencia. El carbono puede compartir electrones con otros átomos para completar su capa de valencia y alcanzar la estabilidad.
Conclusión
El enlace químico es lo que mantiene unidos a los átomos. Ocurre en varias partes del átomo, incluyendo el núcleo, la nube electrónica y la capa de valencia. Los enlaces covalentes y iónicos son dos tipos comunes de enlaces químicos.
Preguntas frecuentes
1. ¿Qué es la electronegatividad?
La electronegatividad es la medida de la capacidad de un átomo para atraer electrones hacia sí mismo.
2. ¿Qué es un enlace covalente?
Un enlace covalente es un enlace químico en el que los átomos comparten electrones en su nube electrónica.
3. ¿Qué es un enlace iónico?
Un enlace iónico es un enlace químico en el que los átomos transfieren electrones entre sí.
4. ¿Qué es la capa de valencia?
La capa de valencia es la capa más externa de electrones en un átomo. Es donde ocurren la mayoría de los enlaces químicos.
5. ¿Qué es la estabilidad de un átomo?
La estabilidad de un átomo se refiere a la capacidad del átomo para tener una capa de valencia completa. Los átomos buscan completar su capa de valencia para alcanzar la estabilidad.
Deja una respuesta