El revolucionario modelo atómico de Bohr: origen y descubrimientos
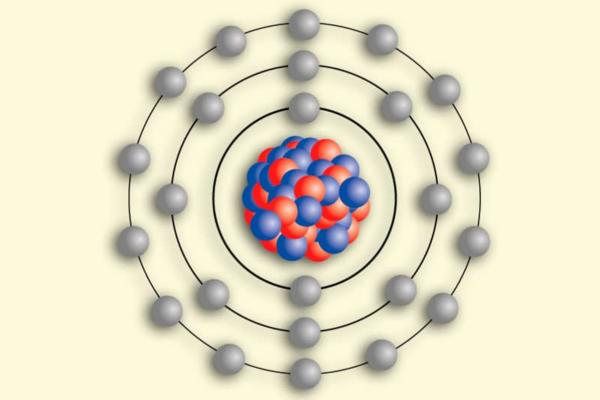
El modelo atómico de Bohr fue un descubrimiento revolucionario en la historia de la física que cambió la forma en que entendemos la estructura de los átomos. Fue propuesto por el físico danés Niels Bohr en 1913 y su desarrollo se basó en los trabajos previos de otros científicos como J.J. Thomson y Ernest Rutherford.
- Origen del modelo atómico de Bohr
- Los descubrimientos del modelo atómico de Bohr
- La importancia del modelo atómico de Bohr
- Preguntas frecuentes
- ¿Cómo influyó el modelo atómico de Bohr en la física moderna?
- ¿Cómo se relaciona el modelo atómico de Bohr con la espectroscopía?
- ¿Cómo se relaciona el modelo atómico de Bohr con la estructura de los átomos de hidrógeno?
- ¿Cómo se relaciona el modelo atómico de Bohr con el desarrollo de la bomba atómica?
- ¿Cuál fue la importancia del modelo atómico de Bohr en la historia de la física?
Origen del modelo atómico de Bohr
En la época en la que Bohr desarrolló su modelo, la teoría atómica más aceptada era la de Thomson, que consideraba al átomo como una esfera uniforme con cargas positivas y negativas distribuidas de manera uniforme. Sin embargo, este modelo no explicaba ciertos fenómenos observados en la naturaleza, como la emisión de luz por los átomos.
Bohr trabajaba en el laboratorio de Rutherford en Manchester, donde se realizaban experimentos con partículas alfa. A partir de estos experimentos, Bohr llegó a la conclusión de que los átomos debían tener una estructura más compleja, con electrones orbitando alrededor del núcleo.
Los descubrimientos del modelo atómico de Bohr
El modelo atómico de Bohr propone que los electrones se mueven en órbitas estables alrededor del núcleo, y que cada órbita tiene una energía específica. Cuando un electrón absorbe o emite energía, cambia de órbita, lo que produce la emisión de luz por parte de los átomos.
Este modelo permitió explicar fenómenos como la espectroscopía, que es el estudio de la luz emitida o absorbida por los átomos. Bohr descubrió que cada elemento químico tiene un espectro de emisión único, lo que significa que la luz emitida por cada elemento tiene longitudes de onda específicas que corresponden a las transiciones de los electrones entre órbitas.
Además, el modelo de Bohr permitió explicar la estructura de los átomos de hidrógeno, que tienen un solo electrón orbitando alrededor del núcleo. Bohr demostró que los electrones sólo podían orbitar en ciertas órbitas específicas, y que estas órbitas estaban determinadas por la energía del electrón.
La importancia del modelo atómico de Bohr
El modelo atómico de Bohr fue un gran avance en la comprensión de la estructura de los átomos, y sentó las bases para el desarrollo de la mecánica cuántica en el siglo XX. Además, permitió explicar una gran cantidad de fenómenos observados en la naturaleza, como la emisión de luz por los átomos y la estructura de los espectros de emisión.
El modelo de Bohr también fue importante porque demostró que la teoría atómica de Thomson era incorrecta, y que los átomos tenían una estructura mucho más compleja de lo que se pensaba en ese momento.
Preguntas frecuentes
¿Cómo influyó el modelo atómico de Bohr en la física moderna?
El modelo atómico de Bohr fue uno de los primeros pasos hacia la comprensión de la mecánica cuántica, que es la teoría fundamental que describe el comportamiento de los átomos y las partículas subatómicas. El modelo de Bohr permitió explicar fenómenos como la emisión de luz por los átomos y sentó las bases para el desarrollo posterior de la mecánica cuántica.
¿Cómo se relaciona el modelo atómico de Bohr con la espectroscopía?
El modelo atómico de Bohr permitió explicar la estructura de los espectros de emisión de los átomos, que es el patrón de luz emitido por los átomos cuando se les da energía. El modelo de Bohr demostró que los electrones sólo podían orbitar en ciertas órbitas específicas, y que estas órbitas estaban determinadas por la energía del electrón. Esto explicó por qué los espectros de emisión de cada elemento químico tienen longitudes de onda específicas que corresponden a las transiciones de los electrones entre órbitas.
¿Cómo se relaciona el modelo atómico de Bohr con la estructura de los átomos de hidrógeno?
El modelo atómico de Bohr permitió explicar la estructura de los átomos de hidrógeno, que tienen un solo electrón orbitando alrededor del núcleo. Bohr demostró que los electrones sólo podían orbitar en ciertas órbitas específicas, y que estas órbitas estaban determinadas por la energía del electrón. Esto permitió explicar por qué el átomo de hidrógeno tiene una estructura única, con un solo electrón orbitando en una sola órbita.
¿Cómo se relaciona el modelo atómico de Bohr con el desarrollo de la bomba atómica?
El modelo atómico de Bohr no tuvo una relación directa con el desarrollo de la bomba atómica, pero su trabajo en el laboratorio de Rutherford en Manchester fue un paso importante en el estudio de la física nuclear, que fue fundamental para el desarrollo de la bomba atómica durante la Segunda Guerra Mundial.
¿Cuál fue la importancia del modelo atómico de Bohr en la historia de la física?
El modelo atómico de Bohr fue un gran avance en la comprensión de la estructura de los átomos, y sentó las bases para el desarrollo de la mecánica cuántica en el siglo XX. Además, permitió explicar una gran cantidad de fenómenos observados en la naturaleza, como la emisión de luz por los átomos y la estructura de los espectros de emisión. El modelo de Bohr también fue importante porque demostró que la teoría atómica de Thomson era incorrecta, y que los átomos tenían una estructura mucho más compleja de lo que se pensaba en ese momento.
Deja una respuesta