El ion: la base estructural de los compuestos iónicos
Los compuestos iónicos son sustancias que están compuestas por iones, que son átomos que han perdido o ganado electrones y, por lo tanto, tienen una carga eléctrica neta. Estos iones se mantienen unidos por fuerzas electrostáticas para formar un compuesto. Los compuestos iónicos son comunes en la naturaleza y tienen muchas aplicaciones prácticas en la vida cotidiana, desde la producción de energía hasta la medicina.
En este artículo, exploraremos la base estructural de los compuestos iónicos y cómo los iones interactúan para formar compuestos estables.
- ¿Qué es un ion?
- ¿Cómo se forman los compuestos iónicos?
- ¿Cómo se representa un compuesto iónico?
- ¿Qué propiedades tienen los compuestos iónicos?
- ¿Cuáles son algunos ejemplos de compuestos iónicos?
- Conclusión
- Preguntas frecuentes
- 1. ¿Por qué los compuestos iónicos tienen puntos de fusión y ebullición más altos que los compuestos moleculares?
- 2. ¿Por qué los compuestos iónicos son solubles en agua?
- 3. ¿Por qué los compuestos iónicos no conducen electricidad en estado sólido?
- 4. ¿Qué sucede cuando se disuelve un compuesto iónico en agua?
- 5. ¿Cuál es la fórmula química del cloruro de calcio?
¿Qué es un ion?
Un ion es un átomo que ha perdido o ganado electrones, lo que resulta en una carga eléctrica neta. Los iones cargados positivamente se llaman cationes y los iones cargados negativamente se llaman aniones. Los iones se forman cuando los átomos ganan o pierden electrones para alcanzar la configuración electrónica estable de un gas noble.
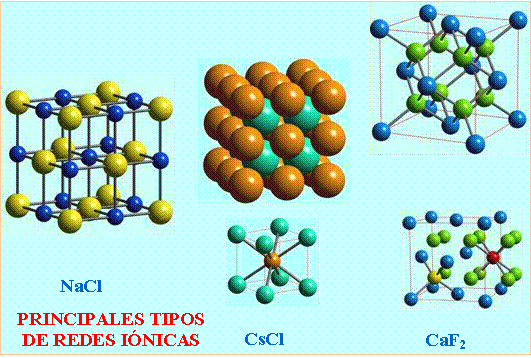
Por ejemplo, el cloruro de sodio (NaCl) es un compuesto iónico común que se forma cuando un átomo de sodio (Na) pierde un electrón para convertirse en un catión con una carga positiva (Na+), y un átomo de cloro (Cl) gana ese electrón para convertirse en un anión con una carga negativa (Cl-). Las fuerzas electrostáticas mantienen estos iones juntos para formar el compuesto iónico NaCl.
¿Cómo se forman los compuestos iónicos?
Los compuestos iónicos se forman cuando los iones con cargas opuestas se atraen entre sí y se unen para formar una estructura cristalina. La estructura cristalina se forma cuando los iones se organizan en una red tridimensional repetitiva de iones positivos y negativos.
Los iones positivos y negativos se atraen entre sí debido a la fuerza electrostática, que es la fuerza que se produce entre dos objetos cargados eléctricamente. La magnitud de la fuerza electrostática depende de la carga de los iones y de la distancia entre ellos. Cuanto mayor sea la carga de los iones y más cerca estén, mayor será la fuerza electrostática entre ellos.
¿Cómo se representa un compuesto iónico?
Los compuestos iónicos se representan mediante fórmulas químicas que indican la proporción de iones en el compuesto. La fórmula química de un compuesto iónico muestra primero el catión y luego el anión. Por ejemplo, la fórmula química del cloruro de sodio es NaCl, lo que indica que hay un ion de sodio por cada ion de cloruro en el compuesto.
Las fórmulas químicas también indican la proporción de iones en el compuesto. Por ejemplo, el sulfato de calcio (CaSO4) contiene un ion de calcio (Ca2+) por cada ion de sulfato (SO42-) y cuatro iones de oxígeno (O2-).
¿Qué propiedades tienen los compuestos iónicos?
Los compuestos iónicos tienen propiedades únicas que los distinguen de otros tipos de compuestos. Algunas de las propiedades más notables incluyen:
- Puntos de fusión y ebullición altos: los compuestos iónicos tienen puntos de fusión y ebullición más altos que los compuestos moleculares debido a las fuerzas electrostáticas fuertes que mantienen los iones juntos.
- Solubilidad: la solubilidad de los compuestos iónicos depende de la polaridad del solvente. Los compuestos iónicos son solubles en solventes polares como el agua, pero no son solubles en solventes no polares como el aceite.
- Conductividad eléctrica: los compuestos iónicos no conducen electricidad en estado sólido, pero sí conducen electricidad en estado líquido o en solución acuosa. Esto se debe a que los iones pueden moverse libremente en estado líquido o en solución acuosa y, por lo tanto, pueden transportar una carga eléctrica.
¿Cuáles son algunos ejemplos de compuestos iónicos?
Los compuestos iónicos son comunes en la naturaleza y en la vida cotidiana. Algunos ejemplos de compuestos iónicos incluyen:
- Cloruro de sodio (NaCl)
- Sulfato de calcio (CaSO4)
- Nitrato de potasio (KNO3)
- Carbonato de calcio (CaCO3)
- Óxido de magnesio (MgO)
- Fosfato de sodio (Na3PO4)
Conclusión
El ion es la base estructural de los compuestos iónicos. Los iones se forman cuando los átomos ganan o pierden electrones y se mantienen unidos por fuerzas electrostáticas para formar un compuesto. Los compuestos iónicos tienen propiedades únicas que los distinguen de otros tipos de compuestos, incluyendo puntos de fusión y ebullición altos, solubilidad y conductividad eléctrica. Los compuestos iónicos son comunes en la naturaleza y tienen muchas aplicaciones prácticas en la vida cotidiana.
Preguntas frecuentes
1. ¿Por qué los compuestos iónicos tienen puntos de fusión y ebullición más altos que los compuestos moleculares?
Los compuestos iónicos tienen puntos de fusión y ebullición más altos que los compuestos moleculares debido a las fuerzas electrostáticas fuertes que mantienen los iones juntos. En los compuestos moleculares, las moléculas están unidas por enlaces covalentes, que son más débiles que las fuerzas electrostáticas.
2. ¿Por qué los compuestos iónicos son solubles en agua?
Los compuestos iónicos son solubles en agua porque el agua es un solvente polar y los iones son cargas eléctricas separadas que pueden interactuar con las cargas eléctricas del agua.
3. ¿Por qué los compuestos iónicos no conducen electricidad en estado sólido?
Los compuestos iónicos no conducen electricidad en estado sólido porque los iones están fijos en su lugar y no pueden moverse libremente para transportar una carga eléctrica.
4. ¿Qué sucede cuando se disuelve un compuesto iónico en agua?
Cuando se disuelve un compuesto iónico en agua, los iones se separan y se dispersan en la solución. Los iones pueden moverse libremente en la solución y, por lo tanto, pueden transportar una carga eléctrica.
5. ¿Cuál es la fórmula química del cloruro de calcio?
La fórmula química del cloruro de calcio es CaCl2, lo que indica
Deja una respuesta