Distribución electrónica: ejemplos de elementos químicos
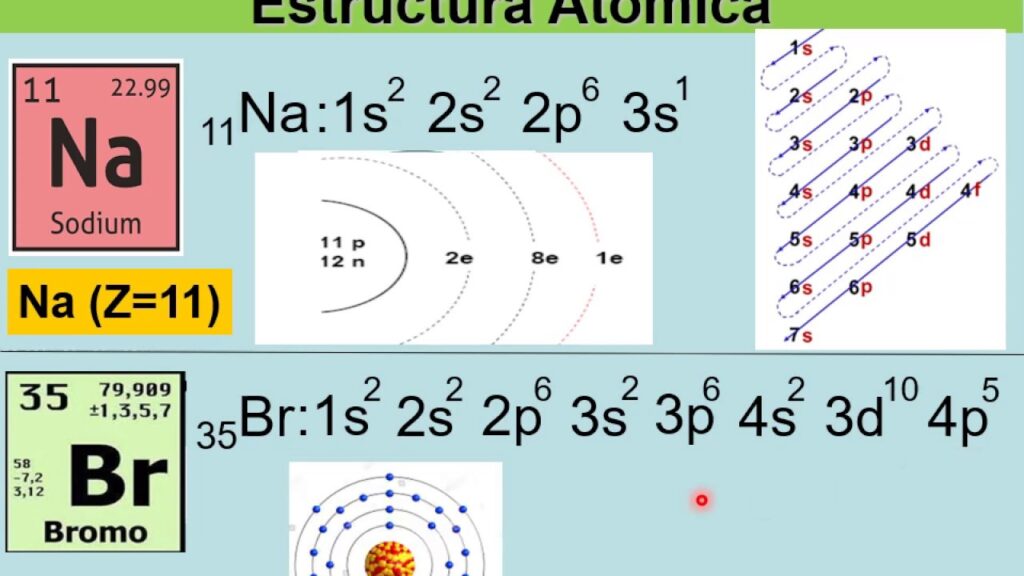
La distribución electrónica es una de las herramientas más importantes en la química para entender la estructura de los átomos y las propiedades de los elementos. Es una descripción de cómo se distribuyen los electrones en los diferentes orbitales alrededor del núcleo del átomo. En este artículo, vamos a hablar sobre algunos ejemplos de elementos químicos y su distribución electrónica.
¿Qué es la distribución electrónica?
Antes de adentrarnos en los ejemplos, es importante entender qué es la distribución electrónica. Los electrones se distribuyen en diferentes orbitales alrededor del núcleo del átomo. Estos orbitales se dividen en niveles de energía, que se representan por números cuánticos. El nivel de energía más cercano al núcleo tiene un número cuántico principal de 1, y a medida que se alejan del núcleo, los números cuánticos principales aumentan.
Cada nivel de energía se divide en subniveles, que se representan por letras. El subnivel s tiene forma esférica y puede contener un máximo de dos electrones. Los subniveles p tienen forma de lágrima y pueden contener un máximo de seis electrones. Los subniveles d tienen forma de cuatro hojas y pueden contener un máximo de diez electrones. Los subniveles f tienen una forma más complicada y pueden contener un máximo de catorce electrones.
Ejemplos de distribución electrónica
Ahora que tenemos una comprensión básica de cómo funciona la distribución electrónica, podemos hablar sobre algunos ejemplos de elementos químicos.
1. Hidrógeno (H)
El hidrógeno es el elemento más simple y tiene un solo electrón. Su distribución electrónica es 1s1, lo que significa que su electrón se encuentra en el nivel de energía más cercano al núcleo en el subnivel s.
2. Helio (He)
El helio es el siguiente elemento en la tabla periódica y tiene dos electrones. Su distribución electrónica es 1s2, lo que significa que ambos electrones se encuentran en el nivel de energía más cercano al núcleo en el subnivel s.
3. Litio (Li)
El litio es el tercer elemento en la tabla periódica y tiene tres electrones. Su distribución electrónica es 1s2 2s1, lo que significa que dos electrones están en el nivel de energía más cercano al núcleo en el subnivel s, y el tercer electrón se encuentra en el subnivel s del segundo nivel de energía.
4. Carbono (C)
El carbono es el sexto elemento en la tabla periódica y tiene seis electrones. Su distribución electrónica es 1s2 2s2 2p2, lo que significa que dos electrones están en el nivel de energía más cercano al núcleo en el subnivel s, dos electrones están en el subnivel p del segundo nivel de energía, y los últimos dos electrones están en el subnivel p del tercer nivel de energía.
5. Hierro (Fe)
El hierro es el vigésimo sexto elemento en la tabla periódica y tiene 26 electrones. Su distribución electrónica es 1s2 2s2 2p6 3s2 3p6 4s2 3d6, lo que significa que los primeros 18 electrones están en los niveles de energía más cercanos al núcleo, y los últimos ocho electrones están en el subnivel d del cuarto nivel de energía.
Conclusión
La distribución electrónica es una herramienta crucial en la química para comprender la estructura de los átomos y las propiedades de los elementos. Con una comprensión básica de cómo funcionan los niveles y subniveles de energía, podemos entender fácilmente la distribución electrónica de cualquier elemento químico.
Preguntas frecuentes
1. ¿Cómo se determina la distribución electrónica de un elemento químico?
La distribución electrónica se determina por la cantidad de electrones en cada nivel y subnivel de energía alrededor del núcleo del átomo.
2. ¿Por qué es importante la distribución electrónica?
La distribución electrónica es importante porque determina las propiedades químicas y físicas de los elementos, como su reactividad, capacidad para formar enlaces y estructura atómica.
3. ¿Qué es un orbital?
Un orbital es un espacio alrededor del núcleo atómico donde se puede encontrar un electrón con una alta probabilidad.
4. ¿Qué es un subnivel de energía?
Un subnivel de energía es una división de un nivel de energía que describe la forma y la orientación de los orbitales en los que se pueden encontrar los electrones.
5. ¿Qué es un número cuántico?
Un número cuántico es un número que describe la energía, el momento angular y la orientación de un electrón en un átomo.
Deja una respuesta