Descubre por qué la electronegatividad crece en un periodo
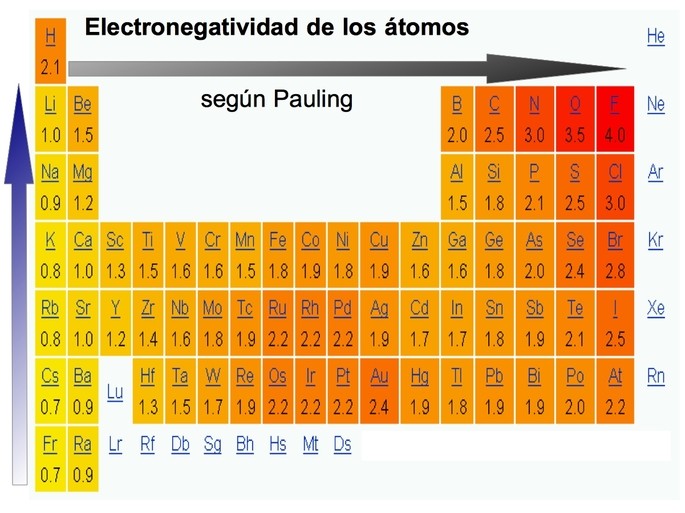
La electronegatividad es una propiedad química que mide la capacidad de un átomo de atraer electrones hacia sí mismo. Esta propiedad varía en la tabla periódica y sigue un patrón específico: la electronegatividad tiende a aumentar de izquierda a derecha en un periodo. ¿Por qué sucede esto?
Para entenderlo, primero debemos recordar la estructura de la tabla periódica. Los elementos están dispuestos en filas horizontales llamadas periodos, y en columnas verticales llamadas grupos o familias. La posición de un elemento en la tabla periódica está determinada por su configuración electrónica, es decir, la distribución de electrones en sus niveles de energía.
Cuando nos movemos de izquierda a derecha en un periodo, la carga nuclear efectiva aumenta. La carga nuclear efectiva es la carga positiva que siente un electrón en un átomo, teniendo en cuenta la atracción de los electrones de otros átomos y las repulsiones entre los electrones del mismo átomo. En otras palabras, a medida que nos acercamos al núcleo del átomo, la carga positiva del núcleo se hace más fuerte y atrae con mayor fuerza a los electrones que están en los niveles más externos.
Esto hace que los átomos de los elementos en un periodo tengan una mayor electronegatividad a medida que avanzamos de izquierda a derecha. Los átomos de los elementos más a la derecha de un periodo tienen una mayor electronegatividad porque tienen una carga nuclear efectiva mayor, lo que significa que pueden atraer con mayor fuerza a los electrones de otros átomos.
Además, los átomos de los elementos más a la derecha de un periodo tienen una configuración electrónica cercana a la configuración del gas noble más cercano. Los gases nobles son elementos muy estables que tienen una configuración electrónica completa en su nivel más externo. Los átomos de los elementos a la derecha de un periodo intentan completar su nivel más externo para alcanzar una configuración similar a la de los gases nobles, lo que significa que tienen una mayor tendencia a atraer electrones.
La electronegatividad crece en un periodo porque los átomos tienen una mayor carga nuclear efectiva a medida que avanzamos de izquierda a derecha, y porque los átomos de los elementos más a la derecha tienen una mayor tendencia a completar su nivel más externo para alcanzar una configuración electrónica similar a la de los gases nobles.
¿Por qué la electronegatividad no aumenta en una columna?
A diferencia de lo que sucede en un periodo, la electronegatividad no aumenta de arriba abajo en una columna de la tabla periódica. En cambio, la electronegatividad disminuye en una columna.
Esto se debe a que, a medida que nos movemos hacia abajo en una columna, la distancia entre el núcleo del átomo y los electrones externos aumenta. Esto significa que la carga nuclear efectiva disminuye, lo que hace que los átomos atraigan con menos fuerza a los electrones de otros átomos.
Además, a medida que nos movemos hacia abajo en una columna, la energía de los niveles de energía aumenta. Esto significa que los electrones de los átomos más abajo en una columna están más lejos del núcleo y son menos atraídos por la carga positiva del núcleo.
¿Cómo se utiliza la electronegatividad en la química?
La electronegatividad es una propiedad importante en la química porque nos ayuda a predecir la polaridad de los enlaces químicos y la distribución de carga en las moléculas. Los enlaces químicos pueden ser covalentes o iónicos.
En un enlace covalente, los átomos comparten electrones para completar su nivel más externo. La electronegatividad de los átomos determina cómo se comparten los electrones. Si los átomos tienen una diferencia de electronegatividad baja, los electrones se comparten de manera equitativa y el enlace es no polar. Si los átomos tienen una diferencia de electronegatividad alta, uno de los átomos atrae con más fuerza a los electrones y el enlace es polar.
En un enlace iónico, los átomos pierden o ganan electrones para completar su nivel más externo. La electronegatividad de los átomos determina cuál átomo pierde electrones y cuál átomo los gana. Si hay una gran diferencia de electronegatividad entre los átomos, el enlace será iónico.
¿Cómo se mide la electronegatividad?
La electronegatividad se mide utilizando la escala de electronegatividad de Pauling. Esta escala asigna un valor numérico a la electronegatividad de cada elemento. El elemento más electronegativo es el flúor, con un valor de electronegatividad de 4.0. Los elementos menos electronegativos son los metales alcalinos y los metales alcalinotérreos, con valores de electronegatividad inferiores a 1.0.
¿Cómo se relaciona la electronegatividad con la reactividad química?
La electronegatividad está relacionada con la reactividad química porque los átomos con una electronegatividad alta tienen una mayor tendencia a atraer electrones de otros átomos. Esto significa que los átomos con una electronegatividad alta son más propensos a formar enlaces químicos y a reaccionar con otros átomos.
Los elementos más electronegativos, como el flúor y el oxígeno, son muy reactivos y forman enlaces químicos con muchos otros elementos. Los elementos menos electronegativos, como los metales alcalinos y alcalinotérreos, son menos reactivos y forman enlaces químicos con menos elementos.
¿Cómo afecta la electronegatividad a las propiedades físicas de los elementos?
La electronegatividad no tiene un efecto directo en las propiedades físicas de los elementos, como el punto de fusión o la densidad. Sin embargo, la electronegatividad puede tener un efecto indirecto en las propiedades físicas de las moléculas que forman los elementos.
Por ejemplo, las moléculas con enlaces polares tienden a tener puntos de ebullición y puntos de fusión más altos que las moléculas con enlaces no polares. Esto se debe a que los enlaces polares son más fuertes y requieren más energía para romperse.
La electronegatividad es una propiedad química que aumenta de izquierda a derecha en un periodo debido a la mayor carga nuclear efectiva de los átomos y su tendencia a completar su nivel más externo. La electronegatividad disminuye de arriba abajo en una columna debido a la disminución de la carga nuclear efectiva y el aumento de la energía de los niveles de energía. La electronegatividad es importante en la química porque nos ayuda a predec
Deja una respuesta