Descubre los números de oxidación de los elementos
Si estás estudiando química, uno de los conceptos fundamentales que debes aprender son los números de oxidación de los elementos. Estos números representan la carga eléctrica que un átomo adquiere cuando forma un enlace químico con otro átomo. Conocer los números de oxidación de los elementos te permitirá entender cómo se forman los compuestos químicos y cómo reaccionan entre sí.
En este artículo, te explicaré en detalle qué son los números de oxidación, cómo se determinan y algunos ejemplos prácticos para que puedas entenderlo mejor.
- ¿Qué son los números de oxidación?
- ¿Cómo se determinan los números de oxidación?
- Ejemplos prácticos
- Conclusión
- Preguntas frecuentes
- 1. ¿Qué es la oxidación y la reducción?
- 2. ¿Por qué el oxígeno tiene un número de oxidación de -2?
- 3. ¿Cómo se determina el número de oxidación de un ion?
- 4. ¿Por qué los metales alcalinos tienen un número de oxidación de +1?
- 5. ¿Por qué el hidrógeno tiene un número de oxidación de +1 en la mayoría de los compuestos?
¿Qué son los números de oxidación?
Los números de oxidación son valores que indican la carga eléctrica de un átomo dentro de un compuesto químico. La oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones. Cuando un átomo pierde electrones, su número de oxidación se vuelve positivo, mientras que cuando gana electrones, su número de oxidación se vuelve negativo.
Por ejemplo, en el compuesto NaCl (cloruro de sodio), el sodio tiene un número de oxidación de +1, mientras que el cloro tiene un número de oxidación de -1. Esto se debe a que el sodio pierde un electrón para formar un enlace iónico con el cloro, mientras que el cloro gana ese electrón.
¿Cómo se determinan los números de oxidación?
Para determinar los números de oxidación de los elementos en un compuesto químico, debes seguir algunas reglas básicas:
- El número de oxidación de un átomo en su estado libre (sin formar un enlace) es siempre cero.
- El número de oxidación de un ion monoatómico es igual a la carga del ion.
- El número de oxidación de los metales alcalinos (como el sodio y el potasio) es siempre +1.
- El número de oxidación de los metales alcalinotérreos (como el calcio y el magnesio) es siempre +2.
- El número de oxidación del oxígeno en un compuesto es casi siempre -2. La única excepción es en los peróxidos, donde el número de oxidación del oxígeno es -1.
- El número de oxidación del hidrógeno en un compuesto es casi siempre +1. La única excepción es en los hidruros metálicos, donde el número de oxidación del hidrógeno es -1.
Siguiendo estas reglas, puedes determinar los números de oxidación de los elementos en cualquier compuesto químico.
Ejemplos prácticos
Veamos algunos ejemplos prácticos para entender mejor cómo se determinan los números de oxidación de los elementos.
Ejemplo 1: H2SO4 (ácido sulfúrico)
En este compuesto, el hidrógeno tiene un número de oxidación de +1 (siguiendo la regla de que el hidrógeno en un compuesto es casi siempre +1), mientras que el oxígeno tiene un número de oxidación de -2 (siguiendo la regla de que el oxígeno en un compuesto es casi siempre -2). Para determinar el número de oxidación del azufre, debemos hacer una ecuación:
2(+1) + x + 4(-2) = 0
Resolviendo la ecuación, obtenemos que el número de oxidación del azufre es +6.
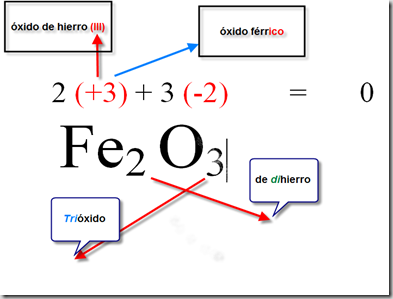
Ejemplo 2: FeCl3 (cloruro férrico)
En este compuesto, el cloro tiene un número de oxidación de -1 (siguiendo la regla de que el cloro en un compuesto es casi siempre -1), mientras que el hierro tiene un número de oxidación que debemos determinar. Haciendo una ecuación, obtenemos:
3(-1) + x = 0
Resolviendo la ecuación, obtenemos que el número de oxidación del hierro es +3.
Conclusión
Los números de oxidación son una herramienta fundamental para entender la química de los compuestos. Conociendo las reglas básicas para determinar los números de oxidación de los elementos, podrás entender cómo se forman los compuestos químicos y cómo reaccionan entre sí.
Preguntas frecuentes
1. ¿Qué es la oxidación y la reducción?
La oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones. Estos procesos están relacionados con los números de oxidación de los elementos.
2. ¿Por qué el oxígeno tiene un número de oxidación de -2?
El oxígeno tiene un número de oxidación de -2 en la mayoría de los compuestos porque tiene una alta electronegatividad y tiende a atraer electrones hacia sí mismo.
3. ¿Cómo se determina el número de oxidación de un ion?
El número de oxidación de un ion monoatómico es igual a la carga del ion.
4. ¿Por qué los metales alcalinos tienen un número de oxidación de +1?
Los metales alcalinos tienen un número de oxidación de +1 porque tienen un solo electrón en su capa externa, que tienden a perder al formar un enlace.
5. ¿Por qué el hidrógeno tiene un número de oxidación de +1 en la mayoría de los compuestos?
El hidrógeno tiene un número de oxidación de +1 en la mayoría de los compuestos porque tiene solo un electrón en su capa externa y tiende a perderlo al formar un enlace. La única excepción es en los hidruros metálicos, donde el hidrógeno tiene un número de oxidación de -1.
Deja una respuesta