Descubre las propiedades de metales y no metales
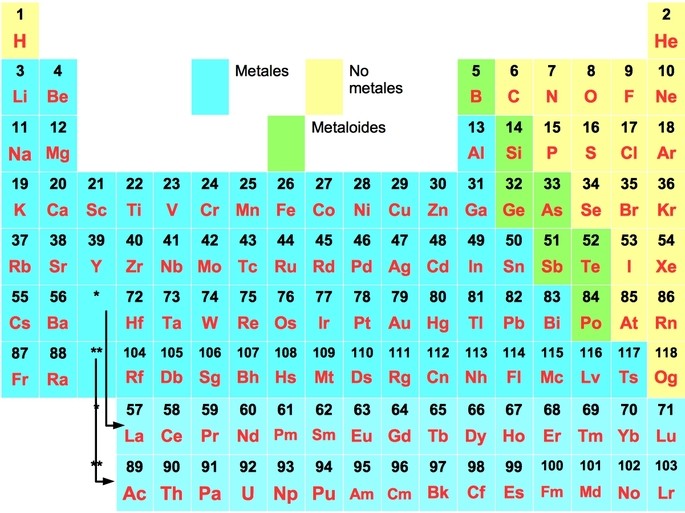
Los elementos químicos se clasifican en diferentes categorías según sus propiedades físicas y químicas. Dos de estas categorías son los metales y los no metales. En este artículo, descubrirás las propiedades de cada uno y cómo se diferencian.
- ¿Qué son los metales?
- ¿Qué son los no metales?
- Conclusiones
- Preguntas frecuentes
- 1. ¿Por qué los metales son buenos conductores de calor y electricidad?
- 2. ¿Todos los metales tienen el mismo brillo?
- 3. ¿Por qué los no metales no son maleables?
- 4. ¿Por qué algunos no metales son gases mientras que otros son sólidos?
- 5. ¿Por qué los puntos de fusión y ebullición de los metales son más altos que los de los no metales?
¿Qué son los metales?
Los metales son elementos químicos que tienen ciertas propiedades comunes, como una alta conductividad térmica y eléctrica, una alta densidad y una maleabilidad. También son sólidos a temperatura ambiente, excepto el mercurio, que es líquido.
Los metales se encuentran en la tabla periódica de elementos a la izquierda de la línea que separa los metales de los no metales. Ejemplos comunes de metales son el hierro, el oro, el cobre y la plata.
Propiedades de los metales
- Conductividad térmica y eléctrica: los metales son buenos conductores de calor y electricidad. Por ejemplo, los cables eléctricos están hechos de cobre debido a su alta conductividad eléctrica.
- Maleabilidad: los metales son maleables, lo que significa que se pueden moldear en formas diferentes sin romperse. Por ejemplo, el oro se puede martillar para hacer láminas muy delgadas.
- Densidad: los metales son generalmente más densos que los no metales. Por ejemplo, el hierro tiene una densidad de 7,87 g/cm³, mientras que el carbono tiene una densidad de 2,2 g/cm³.
- Brillo: los metales tienen un brillo característico llamado brillo metálico. Por ejemplo, el oro y la plata tienen un brillo muy distintivo.
- Punto de fusión y ebullición altos: los metales tienen puntos de fusión y ebullición más altos que los no metales. Por ejemplo, el hierro tiene un punto de fusión de 1535°C y un punto de ebullición de 2750°C.
¿Qué son los no metales?
Los no metales son elementos químicos que tienen propiedades opuestas a las de los metales. Tienen una baja conductividad térmica y eléctrica, baja densidad y no son maleables. Además, los no metales son sólidos, líquidos o gases a temperatura ambiente.
Los no metales se encuentran en la tabla periódica de elementos a la derecha de la línea que separa los metales de los no metales. Ejemplos comunes de no metales son el oxígeno, el nitrógeno, el carbono y el cloro.
Propiedades de los no metales
- Baja conductividad térmica y eléctrica: los no metales son malos conductores de calor y electricidad. Por ejemplo, el carbono es un mal conductor eléctrico.
- Baja densidad: los no metales son generalmente menos densos que los metales. Por ejemplo, el carbono tiene una densidad de 2,2 g/cm³, mientras que el hierro tiene una densidad de 7,87 g/cm³.
- No son maleables: los no metales no son maleables y no se pueden moldear en formas diferentes. Por ejemplo, el carbono no se puede moldear en láminas delgadas.
- Brillo opaco: los no metales no tienen un brillo metálico y son opacos. Por ejemplo, el carbono y el azufre no tienen un brillo distintivo.
- Punto de fusión y ebullición bajos: los no metales tienen puntos de fusión y ebullición más bajos que los metales. Por ejemplo, el oxígeno tiene un punto de fusión de -218,4°C y un punto de ebullición de -183°C.
Conclusiones
Los metales y los no metales son dos categorías diferentes de elementos químicos con propiedades opuestas. Los metales tienen una alta conductividad térmica y eléctrica, una alta densidad y son maleables, mientras que los no metales tienen una baja conductividad térmica y eléctrica, baja densidad y no son maleables.
Cada uno de ellos tiene características únicas y es importante conocerlas para entender mejor cómo funcionan los elementos químicos. Además, muchas sustancias comunes en la vida cotidiana están compuestas por metales y no metales, como los cables eléctricos, las monedas y los plásticos.
Preguntas frecuentes
1. ¿Por qué los metales son buenos conductores de calor y electricidad?
Los metales son buenos conductores de calor y electricidad debido a su estructura cristalina. Los electrones en los metales se mueven fácilmente y pueden transferir energía térmica y eléctrica.
2. ¿Todos los metales tienen el mismo brillo?
No, aunque los metales generalmente tienen un brillo metálico, el brillo puede variar entre los diferentes metales. Por ejemplo, el cobre tiene un brillo rojizo distintivo, mientras que el hierro tiene un brillo grisáceo.
3. ¿Por qué los no metales no son maleables?
Los no metales no son maleables porque su estructura cristalina no permite que los átomos se deslicen y se muevan fácilmente como en los metales.
4. ¿Por qué algunos no metales son gases mientras que otros son sólidos?
La respuesta a esta pregunta se debe a las diferencias en la estructura atómica y molecular de los diferentes no metales. Algunos no metales tienen moléculas pequeñas y simples que se mantienen juntas como gases, mientras que otros tienen moléculas más grandes y complejas que se mantienen juntas como sólidos.
5. ¿Por qué los puntos de fusión y ebullición de los metales son más altos que los de los no metales?
Los puntos de fusión y ebullición de los metales son más altos que los de los no metales porque los metales tienen enlaces metálicos que son más fuertes que los enlaces covalentes en los no metales. Esto significa que los metales requieren más energía para separar los átomos y derretirlos o hervirlos.
Deja una respuesta