Descubre las partículas fundamentales del átomo
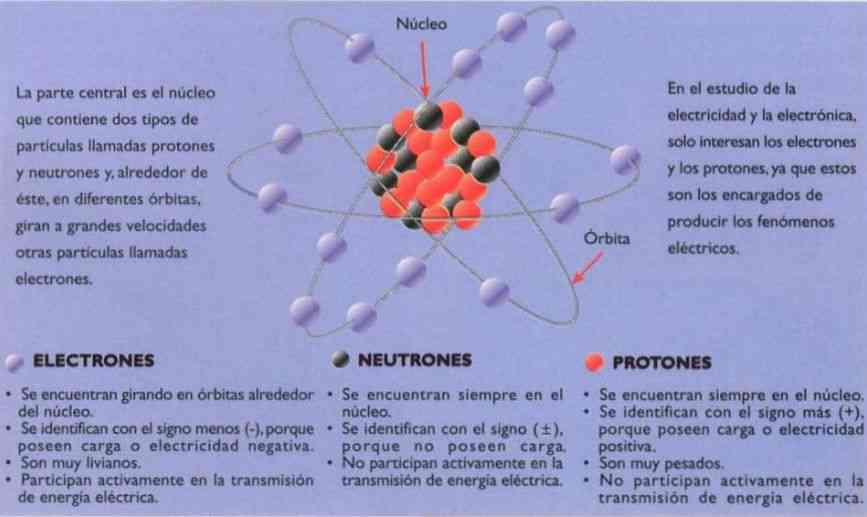
Si alguna vez te has preguntado cómo funciona el mundo a nivel más básico, la respuesta está en los átomos. Los átomos son la unidad básica de la materia, y cada uno de ellos está compuesto por tres partículas fundamentales: protones, neutrones y electrones. En este artículo, profundizaremos en cada una de estas partículas y descubriremos cómo trabajan juntas para formar todo lo que vemos y tocamos.
¿Qué son los protones?
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo. Cada átomo tiene un número específico de protones, llamado número atómico, que determina su identidad química. Por ejemplo, un átomo con seis protones es un átomo de carbono, y un átomo con ocho protones es un átomo de oxígeno.
¿Cómo se descubrieron los protones?
Los protones fueron descubiertos por Ernest Rutherford en 1918 durante su famoso experimento de la lámina de oro. En este experimento, Rutherford disparó partículas alfa (núcleos de helio) a una lámina de oro y observó cómo se dispersaban. Descubrió que la mayoría de las partículas alfa pasaban directamente a través de la lámina de oro, pero algunas eran desviadas en ángulos grandes. Esto llevó a Rutherford a la conclusión de que los átomos están compuestos principalmente de espacio vacío con un núcleo pequeño y denso en el centro que contiene protones.
¿Qué son los neutrones?
Los neutrones son partículas subatómicas sin carga eléctrica que se encuentran en el núcleo del átomo junto con los protones. A diferencia de los protones, el número de neutrones en un átomo puede variar, lo que resulta en diferentes isótopos del mismo elemento. Por ejemplo, el carbono-12 tiene seis protones y seis neutrones, mientras que el carbono-14 tiene seis protones y ocho neutrones.
¿Cómo se descubrieron los neutrones?
Los neutrones fueron descubiertos por James Chadwick en 1932. Chadwick bombardeó berilio con partículas alfa y descubrió que se emitían partículas con carga neutra que eran mucho más penetrantes que los rayos gamma. Demostró que estas partículas sin carga eran en realidad neutrones y que eran esenciales para la estabilidad de los núcleos atómicos.
¿Qué son los electrones?
Los electrones son partículas subatómicas con carga negativa que orbitan alrededor del núcleo del átomo. Son los responsables de las propiedades químicas y eléctricas de los elementos. La cantidad de electrones en un átomo puede variar, y esto determina la carga neta del átomo. Un átomo con igual número de protones y electrones es eléctricamente neutro.
¿Cómo se descubrieron los electrones?
Los electrones fueron descubiertos por J.J. Thomson en 1897. Thomson demostró que los rayos catódicos (corrientes de partículas cargadas negativamente) podían ser desviados por campos eléctricos y magnéticos, lo que demostró que estaban compuestos de partículas subatómicas con carga negativa, que llamó electrones.
Conclusiones
Los átomos están compuestos de protones, neutrones y electrones, que trabajan juntos para formar todo lo que vemos y tocamos. Los protones y neutrones se encuentran en el núcleo del átomo, mientras que los electrones orbitan alrededor del núcleo en capas energéticas. Las propiedades químicas y eléctricas de los elementos están determinadas por la cantidad y distribución de sus electrones. La comprensión de estas partículas fundamentales ha sido esencial para el desarrollo de la tecnología y la ciencia moderna.
Preguntas frecuentes
1. ¿Cuántos electrones, protones y neutrones hay en un átomo?
El número de electrones, protones y neutrones en un átomo varía según el elemento. El número de protones determina la identidad química del átomo, mientras que el número de electrones determina su carga neta. El número de neutrones puede variar, lo que resulta en diferentes isótopos del mismo elemento.
2. ¿Cómo afectan los electrones a las propiedades químicas de un elemento?
Los electrones determinan las propiedades químicas de un elemento porque son responsables de las reacciones químicas y la formación de enlaces químicos. La cantidad y distribución de electrones en la capa externa de un átomo determinan su capacidad para formar enlaces químicos con otros átomos.
3. ¿Qué es un ion?
Un ion es un átomo o molécula que ha perdido o ganado electrones y, por lo tanto, tiene una carga eléctrica neta positiva o negativa. Los iones se forman durante las reacciones químicas cuando los átomos pierden o ganan electrones.
4. ¿Cómo se relacionan los protones y los electrones en un átomo?
Los protones y los electrones están relacionados en un átomo porque los protones determinan la identidad química del átomo y los electrones determinan su carga neta. Un átomo con igual número de protones y electrones es eléctricamente neutro.
5. ¿Por qué son importantes los neutrones?
Los neutrones son importantes porque son esenciales para la estabilidad de los núcleos atómicos. Los núcleos que tienen demasiados protones o demasiados neutrones pueden ser inestables y radioactivos. Los neutrones también son esenciales para la formación de isótopos de elementos, que tienen diferentes números de neutrones y, por lo tanto, diferentes propiedades.
Deja una respuesta