Descubre las partículas clave del átomo en este breve resumen
Los átomos son las unidades básicas de la materia, pero ¿qué los conforma? ¿Cuáles son las partículas clave que lo componen? En este breve resumen, descubriremos las respuestas a estas preguntas y cómo estas partículas interactúan entre sí.
- El núcleo del átomo
- Los electrones
- La carga eléctrica
- La masa atómica
- La tabla periódica
- Los isótopos
- Las reacciones químicas
- La energía y los enlaces químicos
- Las moléculas
- Los compuestos químicos
- Los estados de la materia
- La radiactividad
- El modelo atómico
- La química orgánica e inorgánica
- Conclusión
- Preguntas frecuentes
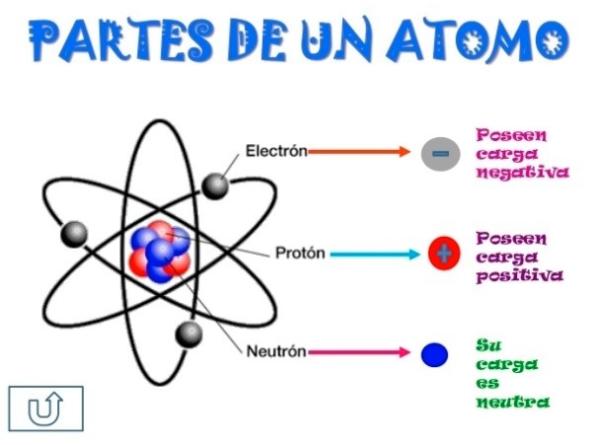
El núcleo del átomo
El núcleo del átomo es el centro del mismo y está compuesto por dos partículas: protones y neutrones. Los protones tienen carga positiva y los neutrones no tienen carga eléctrica. La cantidad de protones en el núcleo define el elemento químico al que pertenece el átomo. Por ejemplo, si un átomo tiene seis protones, es un átomo de carbono.
Los electrones
Los electrones son partículas con carga negativa que orbitan alrededor del núcleo en capas o niveles de energía. La cantidad de electrones en un átomo depende de la cantidad de protones en el núcleo. Los electrones en la capa más externa se denominan electrones de valencia y son los que participan en las reacciones químicas.
La carga eléctrica
La carga eléctrica es la propiedad fundamental de los protones y los electrones. Los protones tienen carga positiva y los electrones tienen carga negativa. Cuando la cantidad de protones y electrones en un átomo es igual, el átomo es eléctricamente neutro. Sin embargo, cuando la cantidad de electrones cambia, el átomo se convierte en un ion cargado positiva o negativamente.
La masa atómica
La masa atómica es la suma de la cantidad de protones y neutrones en el núcleo del átomo. Los electrones tienen una masa mucho menor que la de los protones y neutrones, por lo que no contribuyen significativamente a la masa atómica. La masa atómica se mide en unidades de masa atómica (uma).
La tabla periódica
La tabla periódica es una herramienta útil para organizar los elementos químicos según su número atómico, su configuración electrónica y sus propiedades químicas. Los elementos están ordenados en filas y columnas basadas en su estructura atómica. La tabla periódica se utiliza para predecir las propiedades de los elementos y para entender cómo los átomos interactúan entre sí.
Los isótopos
Los isótopos son átomos de un mismo elemento que tienen la misma cantidad de protones en su núcleo pero una cantidad diferente de neutrones. Esto significa que los isótopos tienen la misma carga eléctrica pero una masa atómica diferente. Algunos isótopos son estables y otros son inestables y se descomponen a través de la radiactividad.
Las reacciones químicas
Las reacciones químicas ocurren cuando los átomos interactúan entre sí para formar nuevas sustancias. Durante una reacción química, los enlaces entre los átomos se rompen y se forman nuevos enlaces. La cantidad de electrones en la capa de valencia es lo que determina la capacidad de un átomo para formar enlaces con otros átomos.
La energía y los enlaces químicos
La formación de enlaces químicos implica un intercambio de energía entre los átomos. Cuando los átomos se unen, se libera energía. Cuando los enlaces se rompen, se absorbe energía. La energía necesaria para romper los enlaces químicos se conoce como energía de enlace.
Las moléculas
Las moléculas son grupos de átomos unidos por enlaces químicos. Las moléculas pueden ser simples o complejas y pueden contener diferentes tipos de átomos. Las moléculas pueden tener propiedades físicas y químicas únicas que las hacen importantes en la biología, la química y la física.
Los compuestos químicos
Los compuestos químicos son sustancias puras compuestas por dos o más elementos diferentes unidos por enlaces químicos. Los compuestos tienen propiedades químicas y físicas únicas que son diferentes a las propiedades de los elementos que los componen.
Los estados de la materia
Los estados de la materia son sólido, líquido y gas. El estado de la materia de una sustancia depende de la energía cinética y de la fuerza de los enlaces químicos entre las moléculas. Los cambios de estado ocurren cuando se agregan o se eliminan energía o se alteran los enlaces químicos entre las moléculas.
La radiactividad
La radiactividad es una propiedad que algunos elementos tienen debido a la inestabilidad de sus núcleos. Los átomos radiactivos emiten partículas y energía en forma de radiación. La radiactividad tiene aplicaciones en la medicina, la energía nuclear y la datación de fósiles y rocas.
El modelo atómico
El modelo atómico es una descripción simplificada de la estructura del átomo. Hay varios modelos atómicos, pero el modelo más comúnmente aceptado es el modelo de Bohr. El modelo de Bohr describe los electrones en capas o niveles de energía y explica cómo los átomos interactúan entre sí.
La química orgánica e inorgánica
La química orgánica se centra en los compuestos que contienen carbono e hidrógeno, mientras que la química inorgánica se centra en los compuestos sin carbono e hidrógeno. La química orgánica es importante en la biología, la medicina y la industria, mientras que la química inorgánica es importante en la química industrial.
Conclusión
Los átomos son la base de la materia y están compuestos por protones, neutrones y electrones. Las propiedades de los átomos y las partículas que los componen son importantes para entender cómo los átomos interactúan entre sí y cómo se forman las moléculas y los compuestos químicos.
Preguntas frecuentes
¿Por qué los electrones orbitan alrededor del núcleo?
Los electrones orbitan alrededor del núcleo debido a las fuerzas electromagnéticas entre los electrones y los protones en el núcleo.
¿Qué es un átomo neutro?
Un átomo neutro tiene la misma cantidad de protones y electrones, lo que significa que la carga eléctrica neta es cero.
¿Qué es un ion?
Un ion es un átomo que ha ganado o perdido electrones, lo que significa que tiene una carga eléctrica neta positiva o negativa.
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman cuando los átomos comparten
Deja una respuesta