Descubre la primera ley de la termodinámica en sistemas cerrados
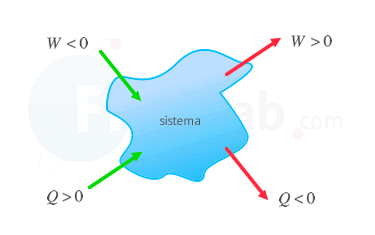
La termodinámica es una rama de la física que se encarga del estudio de los procesos que involucran calor, trabajo y energía. En este campo, la primera ley de la termodinámica es una de las leyes más importantes que rigen el comportamiento de los sistemas cerrados. En este artículo, exploraremos en profundidad la primera ley de la termodinámica y su aplicación en sistemas cerrados.
¿Qué es la primera ley de la termodinámica?
La primera ley de la termodinámica, también conocida como la ley de conservación de la energía, establece que la energía no puede ser creada ni destruida, solo transformada de una forma a otra. En otras palabras, la cantidad total de energía en un sistema cerrado permanece constante.
Esta ley es fundamental para entender cómo la energía fluye dentro de los sistemas cerrados y cómo se puede utilizar para realizar trabajo o producir calor.
¿Qué es un sistema cerrado?
Antes de profundizar en la primera ley de la termodinámica, es importante entender lo que es un sistema cerrado. Un sistema cerrado es aquel que no intercambia materia con su entorno, pero sí puede intercambiar energía en forma de calor o trabajo. Un ejemplo de un sistema cerrado es un termo con líquido caliente. El líquido no puede salir del termo, pero puede transferir calor al exterior o realizar trabajo al mover una rueda.
La primera ley de la termodinámica en acción
La primera ley de la termodinámica se puede aplicar a cualquier sistema cerrado, desde una bomba de calor hasta un motor de combustión interna. En un sistema cerrado, la energía total se conserva, lo que significa que cualquier cambio en la energía de un componente del sistema se compensa con un cambio igual y opuesto en otro componente.
La energía de un sistema cerrado se puede dividir en dos formas: energía interna y energía externa. La energía interna es la energía que se encuentra dentro del sistema, como la energía térmica o la energía química. La energía externa es la energía que se encuentra fuera del sistema, como la energía mecánica o la energía eléctrica.
La primera ley de la termodinámica establece que cualquier cambio en la energía interna de un sistema cerrado debe ser igual al trabajo realizado sobre el sistema y al calor transferido al sistema. Es decir, la energía interna final menos la energía interna inicial es igual al trabajo realizado sobre el sistema más el calor transferido al sistema.
Aplicaciones de la primera ley de la termodinámica
La primera ley de la termodinámica tiene muchas aplicaciones prácticas en la vida cotidiana, desde el funcionamiento de un motor de combustión interna hasta la refrigeración de una casa. A continuación, se presentan algunas de las aplicaciones más comunes de la primera ley de la termodinámica:
1. Motores de combustión interna
Los motores de combustión interna, como los que se utilizan en automóviles y motocicletas, funcionan mediante la combustión de combustible en una cámara de combustión. La energía liberada por la combustión se convierte en trabajo mecánico, que se utiliza para mover el vehículo. La primera ley de la termodinámica se aplica en este caso para explicar cómo la energía química del combustible se convierte en energía mecánica.
2. Refrigeradores
Los refrigeradores funcionan mediante la transferencia de calor de un espacio a otro. El compresor del refrigerador comprime el gas refrigerante, lo que aumenta su temperatura y presión. Luego, el gas se enfría en el condensador y se expande en el evaporador, donde absorbe calor del interior del refrigerador. La primera ley de la termodinámica se aplica en este caso para explicar cómo se puede transferir calor de un espacio frío a un espacio caliente mediante la compresión y expansión de un gas.
3. Paneles solares
Los paneles solares funcionan mediante la conversión de energía solar en energía eléctrica. La luz solar es absorbida por las células solares, que generan una corriente eléctrica. La primera ley de la termodinámica se aplica en este caso para explicar cómo se puede convertir la energía solar en energía eléctrica.
Conclusión
La primera ley de la termodinámica es una ley fundamental en la física que establece que la energía no puede ser creada ni destruida, solo transformada de una forma a otra en un sistema cerrado. Esta ley tiene muchas aplicaciones prácticas en la vida cotidiana, desde el funcionamiento de motores de combustión interna hasta la refrigeración de casas.
Preguntas frecuentes
1. ¿Qué es un sistema cerrado?
Un sistema cerrado es aquel que no intercambia materia con su entorno, pero sí puede intercambiar energía en forma de calor o trabajo.
2. ¿Cuál es la diferencia entre la energía interna y la energía externa?
La energía interna es la energía que se encuentra dentro del sistema, como la energía térmica o la energía química. La energía externa es la energía que se encuentra fuera del sistema, como la energía mecánica o la energía eléctrica.
3. ¿Cuál es la aplicación de la primera ley de la termodinámica en los motores de combustión interna?
La primera ley de la termodinámica se aplica en los motores de combustión interna para explicar cómo la energía química del combustible se convierte en energía mecánica.
4. ¿Cómo funciona un refrigerador?
Un refrigerador funciona mediante la transferencia de calor de un espacio a otro mediante la compresión y expansión de un gas refrigerante.
5. ¿Cómo funcionan los paneles solares?
Los paneles solares funcionan mediante la conversión de energía solar en energía eléctrica mediante células solares.
Deja una respuesta