Descubre la mayor afinidad electrónica en el periodo 4
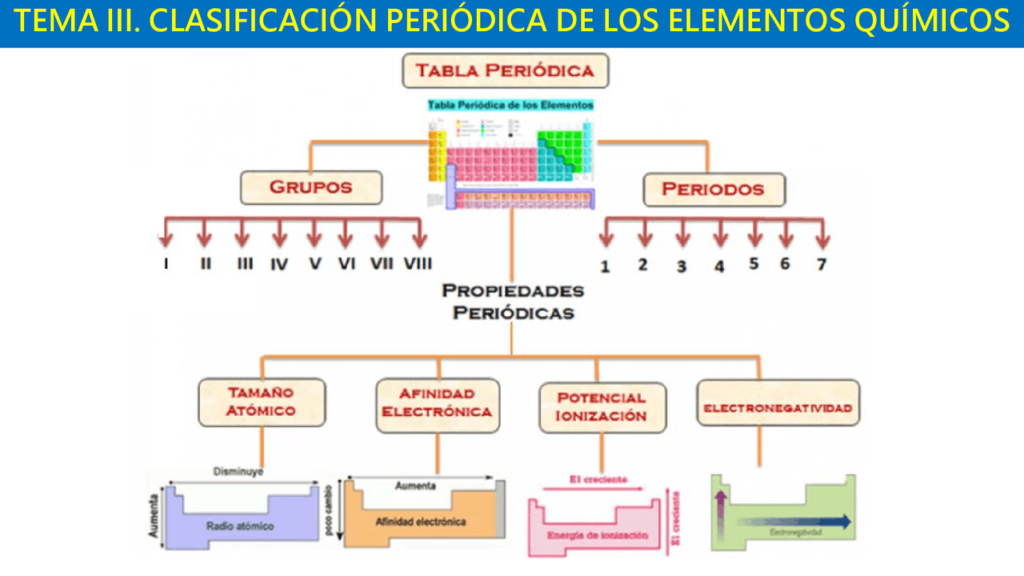
En el estudio de la química, la afinidad electrónica es una medida de la energía liberada cuando un átomo gana un electrón. Esta propiedad es especialmente importante en la formación de enlaces químicos y en la reactividad de los elementos. En el periodo 4 de la tabla periódica, hay varios elementos que tienen afinidades electrónicas notables, pero hay uno que destaca por encima de los demás: el cloro.
- ¿Qué es la afinidad electrónica?
- ¿Por qué el cloro tiene la mayor afinidad electrónica en el periodo 4?
- ¿Cuál es el valor de la afinidad electrónica del cloro?
- ¿Qué otros elementos tienen una alta afinidad electrónica en el periodo 4?
- ¿Cómo se utiliza la afinidad electrónica en la química?
- Conclusión
¿Qué es la afinidad electrónica?
La afinidad electrónica es la energía liberada cuando un átomo gana un electrón y se convierte en un ion negativo. Esta energía se mide en electronvoltios (eV) y suele ser una propiedad negativa, ya que el proceso de ganar un electrón requiere energía. Cuanto mayor sea la afinidad electrónica de un átomo, más energía liberará cuando gane un electrón. Esta propiedad es importante en la formación de enlaces químicos y en la reactividad de los elementos.
¿Por qué el cloro tiene la mayor afinidad electrónica en el periodo 4?
El cloro es el elemento con la mayor afinidad electrónica en el periodo 4 debido a su estructura electrónica. El cloro tiene 17 electrones y su configuración electrónica es 1s2 2s2 2p6 3s2 3p5. Esto significa que tiene 7 electrones en su última capa, lo que lo convierte en un elemento altamente reactivo. Cuando el cloro gana un electrón, su configuración electrónica se convierte en 1s2 2s2 2p6 3s2 3p6, lo que le da una configuración de gas noble similar a la del argón. Este cambio de configuración electrónica libera una gran cantidad de energía, lo que explica por qué el cloro tiene la mayor afinidad electrónica en el periodo 4.
¿Cuál es el valor de la afinidad electrónica del cloro?
El valor de la afinidad electrónica del cloro es de -349 kJ/mol. Este valor indica la cantidad de energía que se libera cuando un átomo de cloro gana un electrón y se convierte en un ion negativo. Como se mencionó anteriormente, este proceso libera una gran cantidad de energía debido al cambio en la configuración electrónica del cloro.
¿Qué otros elementos tienen una alta afinidad electrónica en el periodo 4?
Además del cloro, hay otros elementos en el periodo 4 que tienen una alta afinidad electrónica. Estos incluyen el oxígeno (-141 kJ/mol), el azufre (-200 kJ/mol) y el bromo (-324 kJ/mol). Sin embargo, ninguno de estos elementos tiene una afinidad electrónica tan alta como la del cloro.
¿Cómo se utiliza la afinidad electrónica en la química?
La afinidad electrónica es una propiedad importante en la química porque está relacionada con la reactividad de los elementos. Los elementos con una alta afinidad electrónica son más propensos a formar enlaces iónicos y a reaccionar con otros elementos para ganar o perder electrones. Por otro lado, los elementos con una baja afinidad electrónica son menos propensos a reaccionar y tienden a formar enlaces covalentes. La afinidad electrónica también se utiliza en la predicción de la estabilidad de los iones y en la interpretación de las propiedades de los compuestos químicos.
Conclusión
El cloro tiene la mayor afinidad electrónica en el periodo 4 debido a su estructura electrónica y al cambio en su configuración electrónica cuando gana un electrón. Esta propiedad es importante en la química porque está relacionada con la reactividad de los elementos y se utiliza en la predicción de la estabilidad de los iones y en la interpretación de las propiedades de los compuestos químicos. Aunque hay otros elementos en el periodo 4 con una alta afinidad electrónica, ninguno de ellos se acerca a la del cloro.
Deja una respuesta