Descubre la historia de la estructura atómica en una línea del tiempo
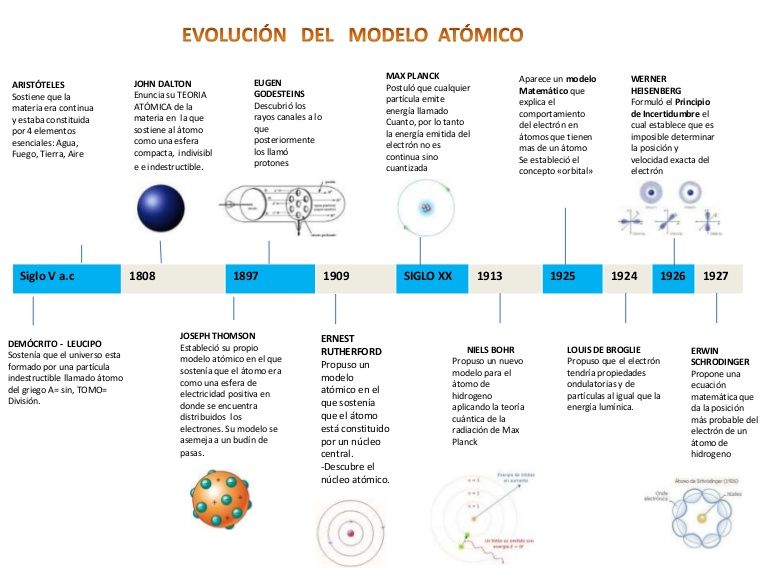
La estructura atómica es una parte fundamental de la química y la física moderna. Desde la antigüedad, los filósofos y científicos han intentado comprender la naturaleza de la materia y cómo se comportan los elementos químicos. En este artículo, te llevaré en un recorrido por la historia de la estructura atómica, desde la antigua Grecia hasta nuestros días, en una línea del tiempo.
- Antigua Grecia: la idea de los átomos
- 1803: la ley de las proporciones múltiples de Dalton
- 1897: el descubrimiento del electrón
- 1911: el modelo atómico de Rutherford
- 1913: el modelo atómico de Bohr
- 1926: el principio de exclusión de Pauli
- 1932: el descubrimiento del neutrón
- 1961: la teoría de la mecánica cuántica
- 1969: la tabla periódica de los elementos
- Actualidad: la exploración de la estructura atómica
Antigua Grecia: la idea de los átomos
En el siglo V a.C., el filósofo griego Leucipo y su discípulo Demócrito propusieron la idea de que toda la materia estaba compuesta de pequeñas partículas indivisibles llamadas átomos. Esta teoría fue desarrollada aún más por el filósofo griego Epicuro, que creía que los átomos existían en una especie de vacío y se movían en línea recta.
1803: la ley de las proporciones múltiples de Dalton
En 1803, el químico británico John Dalton propuso la ley de las proporciones múltiples, que establecía que los elementos químicos se combinan en proporciones fijas y simples para formar compuestos. Dalton también propuso que los átomos eran esferas sólidas e indivisibles.
1897: el descubrimiento del electrón
En 1897, el físico británico J.J. Thomson descubrió el electrón, una partícula subatómica con carga negativa que se encuentra en el átomo. Thomson propuso que los átomos eran esferas con carga positiva que contenían electrones dispersos.
1911: el modelo atómico de Rutherford
En 1911, el físico neozelandés Ernest Rutherford realizó un experimento que demostró que los átomos tenían un núcleo central con carga positiva rodeado por electrones en órbita. Este modelo atómico se conoce como el modelo de Rutherford.
1913: el modelo atómico de Bohr
En 1913, el físico danés Niels Bohr propuso un modelo atómico en el que los electrones se mueven en órbitas circulares alrededor del núcleo en lugar de moverse libremente en el átomo. Este modelo ayudó a explicar la emisión de luz por los átomos.
1926: el principio de exclusión de Pauli
En 1926, el físico austríaco Wolfgang Pauli propuso el principio de exclusión de Pauli, que establece que dos electrones no pueden ocupar el mismo estado cuántico simultáneamente. Este principio es fundamental para entender la estructura electrónica de los átomos y la formación de enlaces químicos.
1932: el descubrimiento del neutrón
En 1932, el físico británico James Chadwick descubrió el neutrón, una partícula subatómica sin carga que se encuentra en el núcleo del átomo. Este descubrimiento ayudó a explicar la estabilidad de los núcleos atómicos.
1961: la teoría de la mecánica cuántica
En 1961, el físico alemán Werner Heisenberg propuso la teoría de la mecánica cuántica, que describe el comportamiento de las partículas subatómicas. Esta teoría es fundamental para entender la estructura atómica y la química cuántica.
1969: la tabla periódica de los elementos
La tabla periódica de los elementos es una herramienta esencial para la química y la física. Fue desarrollada por el químico ruso Dmitry Mendeleev en 1869 y ha sido actualizada y refinada a lo largo de los años.
Actualidad: la exploración de la estructura atómica
En la actualidad, los científicos continúan explorando la estructura atómica y desarrollando nuevas teorías y tecnologías para comprender mejor el mundo que nos rodea. Desde la física de partículas hasta la nanotecnología, la estructura atómica es una parte fundamental de la investigación científica moderna.
Conclusión
La historia de la estructura atómica es una historia fascinante que abarca miles de años de investigación y descubrimientos. Desde la antigua Grecia hasta la actualidad, los científicos han trabajado duro para comprender la naturaleza de la materia y cómo se comportan los elementos químicos. Esta línea del tiempo es solo una pequeña muestra de los logros y descubrimientos que han llevado a nuestra comprensión actual de la estructura atómica.
Preguntas frecuentes
1. ¿Qué es la estructura atómica?
La estructura atómica se refiere a la composición y organización de los átomos, que son las unidades básicas de la materia.
2. ¿Cómo se descubrieron los electrones y los neutrones?
Los electrones fueron descubiertos por J.J. Thomson en 1897, mientras que los neutrones fueron descubiertos por James Chadwick en 1932.
3. ¿Por qué es importante la estructura atómica?
La estructura atómica es importante porque ayuda a explicar el comportamiento de los elementos químicos y la formación de enlaces químicos. También es fundamental para entender la física de partículas y la nanotecnología.
4. ¿Cómo se representan los átomos en la actualidad?
Los átomos se representan como esferas con un núcleo central que contiene protones y neutrones rodeados por electrones en órbita.
5. ¿Qué es la mecánica cuántica?
La mecánica cuántica es una teoría que describe el comportamiento de las partículas subatómicas y es fundamental para entender la estructura atómica y la química cuántica.
Deja una respuesta