Descubre la diferencia entre gases monoatómicos y diatómicos
Los gases son elementos esenciales en nuestra vida diaria y se encuentran en todas partes. Desde el aire que respiramos hasta los gases que se utilizan en la industria, estos elementos son fundamentales para nuestra supervivencia y para el progreso de la humanidad. Sin embargo, no todos los gases son iguales. En este artículo, descubriremos la diferencia entre los gases monoatómicos y diatómicos.
Gases monoatómicos
Los gases monoatómicos son aquellos que consisten en átomos individuales que se mueven libremente en el espacio. Ejemplos de gases monoatómicos son el helio (He), el neón (Ne), el argón (Ar), el criptón (Kr) y el xenón (Xe). Estos gases son llamados "monos" porque cada una de sus moléculas está compuesta por un solo átomo.
Uno de los aspectos más interesantes de los gases monoatómicos es que, en condiciones normales de temperatura y presión (conocidas como CNTP), no suelen reaccionar con otros elementos. Debido a que los gases monoatómicos tienen una estructura atómica simple, no tienen la capacidad de formar enlaces químicos con otros átomos, lo que los convierte en gases inertes.
Gases diatómicos
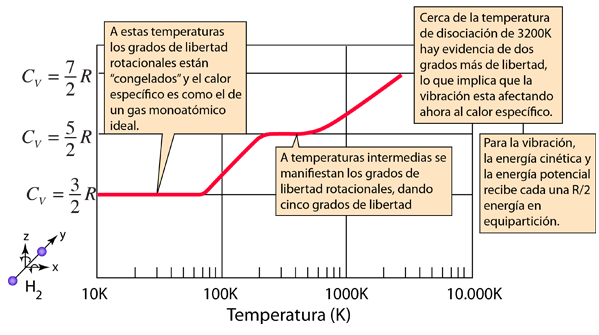
Por otro lado, los gases diatómicos están formados por moléculas compuestas por dos átomos del mismo elemento. Ejemplos de gases diatómicos son el oxígeno (O2), el nitrógeno (N2) y el hidrógeno (H2). A diferencia de los gases monoatómicos, estos gases tienen la capacidad de formar enlaces químicos con otros átomos.
Los gases diatómicos pueden encontrarse en la naturaleza en grandes cantidades, como es el caso del oxígeno y el nitrógeno, que son los principales componentes del aire. Además, estos gases son importantes para la vida en la Tierra. Por ejemplo, el oxígeno es esencial para la respiración y el nitrógeno es un componente clave en la formación de proteínas y otros compuestos orgánicos.
Diferencias entre gases monoatómicos y diatómicos
La principal diferencia entre los gases monoatómicos y diatómicos es la estructura de sus moléculas. Los gases monoatómicos están formados por átomos individuales, mientras que los gases diatómicos consisten en moléculas compuestas por dos átomos del mismo elemento.
Otra diferencia importante es la capacidad de los gases para reaccionar con otros elementos. Los gases monoatómicos son inertes y no reaccionan con otros elementos en condiciones normales de temperatura y presión. Por otro lado, los gases diatómicos tienen la capacidad de formar enlaces químicos con otros átomos y pueden reaccionar con otros elementos para formar compuestos químicos.
Usos de los gases monoatómicos y diatómicos
Tanto los gases monoatómicos como los diatómicos tienen una amplia variedad de aplicaciones en la industria y en la vida cotidiana. Los gases monoatómicos, por ejemplo, se utilizan en láseres, equipos de soldadura, refrigerantes y en la industria de la iluminación. Además, el helio es utilizado en la industria médica para enfriar equipos de resonancia magnética.
Por otro lado, los gases diatómicos tienen una amplia variedad de usos. El oxígeno es utilizado en la respiración, la producción de acero y en la industria química. El nitrógeno se utiliza en la producción de fertilizantes y en la fabricación de productos químicos. El hidrógeno, por su parte, es utilizado en la producción de amoníaco y en la industria petroquímica.
Preguntas frecuentes
¿Qué es un gas inerte?
Un gas inerte es aquel que no reacciona con otros elementos en condiciones normales de temperatura y presión. Los gases monoatómicos, como el helio y el argón, son ejemplos de gases inertes.
¿Por qué los gases monoatómicos son inertes?
Los gases monoatómicos son inertes porque su estructura atómica simple no les permite formar enlaces químicos con otros átomos.
¿Cuál es el gas diatómico más abundante en la atmósfera de la Tierra?
El gas diatómico más abundante en la atmósfera de la Tierra es el nitrógeno, que representa aproximadamente el 78% de la atmósfera.
¿Qué es un enlace químico?
Un enlace químico es una fuerza que mantiene unidos a dos o más átomos para formar una molécula. Los enlaces químicos pueden ser covalentes, iónicos o metálicos.
¿Qué es una molécula?
Una molécula es una unidad fundamental de una sustancia que está formada por dos o más átomos unidos por enlaces químicos. Las moléculas pueden ser monoatómicas, como el helio y el neón, o diatómicas, como el oxígeno y el nitrógeno.
Deja una respuesta