Descubre la diferencia entre el número atómico y el número másico
Cuando se estudia la química, es común encontrarse con términos que pueden resultar confusos para los estudiantes. Uno de ellos es la diferencia entre el número atómico y el número másico. En este artículo, explicaremos en detalle qué son estos números y cómo se diferencian entre sí.
¿Qué es el número atómico?
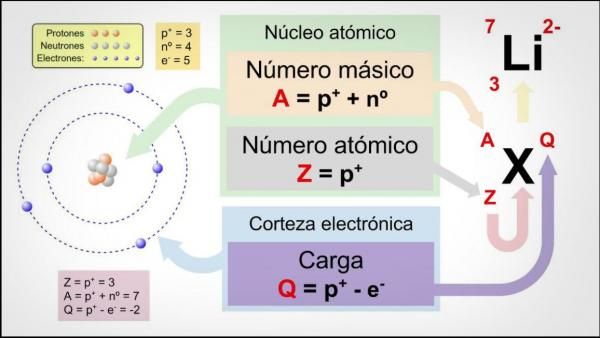
El número atómico es la cantidad de protones que se encuentran en el núcleo de un átomo. Cada elemento químico tiene un número atómico único, lo que significa que no hay dos elementos diferentes con el mismo número atómico. Por ejemplo, el hidrógeno tiene un número atómico de 1, lo que significa que tiene un protón en su núcleo, mientras que el oxígeno tiene un número atómico de 8, lo que significa que tiene ocho protones en su núcleo.
El número atómico también determina la posición de un elemento en la tabla periódica. Los elementos están ordenados en la tabla periódica en orden ascendente de número atómico.
¿Qué es el número másico?
El número másico es la suma del número de protones y el número de neutrones que se encuentran en el núcleo de un átomo. A diferencia del número atómico, el número másico puede variar dentro de un mismo elemento químico, ya que los átomos de un mismo elemento pueden tener diferentes números de neutrones. Estos átomos se conocen como isótopos.
Por ejemplo, el carbono tiene un número atómico de 6, lo que significa que tiene seis protones en su núcleo. Sin embargo, el carbono puede tener diferentes números de neutrones. El carbono-12 tiene seis neutrones, lo que significa que su número másico es de 12 (6 protones + 6 neutrones), mientras que el carbono-14 tiene ocho neutrones, lo que significa que su número másico es de 14 (6 protones + 8 neutrones).
¿Cómo se representan el número atómico y el número másico?
El número atómico se representa con la letra Z, que significa "número de protones". El número másico se representa con la letra A, que significa "número másico". Estos números se escriben como subíndices a la izquierda y a la derecha del símbolo del elemento químico.
Por ejemplo, el isótopo de carbono-12 se escribe como 12C, donde 12 es el número másico y C es el símbolo del elemento químico carbono. El isótopo de carbono-14 se escribe como 14C, donde 14 es el número másico y C es el símbolo del elemento químico carbono.
¿Por qué son importantes el número atómico y el número másico?
El número atómico y el número másico son importantes porque determinan las propiedades químicas de un elemento. El número atómico determina el número de electrones que hay en un átomo neutro del elemento, lo que a su vez determina cómo se combina el elemento con otros elementos para formar compuestos químicos.
Por otro lado, el número másico determina la masa del átomo y, por lo tanto, su estabilidad. Los isótopos con números másicos más altos son inestables y pueden ser radiactivos. La radiactividad puede tener aplicaciones prácticas en la medicina, la energía nuclear y la datación de materiales antiguos.
Resumen:
- El número atómico es la cantidad de protones en el núcleo de un átomo.
- El número másico es la suma de los protones y neutrones en el núcleo de un átomo.
- El número atómico determina la posición de un elemento en la tabla periódica.
- El número másico puede variar dentro de un mismo elemento debido a la presencia de isótopos.
- El número atómico y el número másico se representan como subíndices a la izquierda y a la derecha del símbolo del elemento químico.
- El número atómico y el número másico son importantes para determinar las propiedades químicas y la estabilidad de un elemento.
Preguntas frecuentes:
1. ¿Todos los elementos tienen isótopos?
Sí, todos los elementos tienen isótopos. Algunos elementos tienen isótopos estables, mientras que otros tienen isótopos inestables o radiactivos.
2. ¿Por qué es importante la estabilidad de un átomo?
La estabilidad de un átomo determina su capacidad para formar compuestos químicos y su tendencia a reaccionar con otros elementos. Los átomos inestables pueden ser radiactivos y, por lo tanto, pueden ser peligrosos para la salud y el medio ambiente.
3. ¿Por qué se usan los isótopos radiactivos en la medicina?
Los isótopos radiactivos se utilizan en la medicina para el diagnóstico y el tratamiento de enfermedades. Los isótopos pueden ser inyectados en el cuerpo para rastrear su movimiento, o pueden ser utilizados para destruir células cancerosas.
4. ¿Cuál es el isótopo más común del carbono?
El isótopo más común del carbono es el carbono-12, que tiene seis protones y seis neutrones en su núcleo.
5. ¿Cómo se llaman los isótopos radiactivos que se usan en la energía nuclear?
Los isótopos radiactivos que se usan en la energía nuclear se llaman combustibles nucleares. Los combustibles nucleares más comunes son el uranio-235 y el plutonio-239.
Deja una respuesta