Descubre la composición del carbono: electrones, protones y neutrones
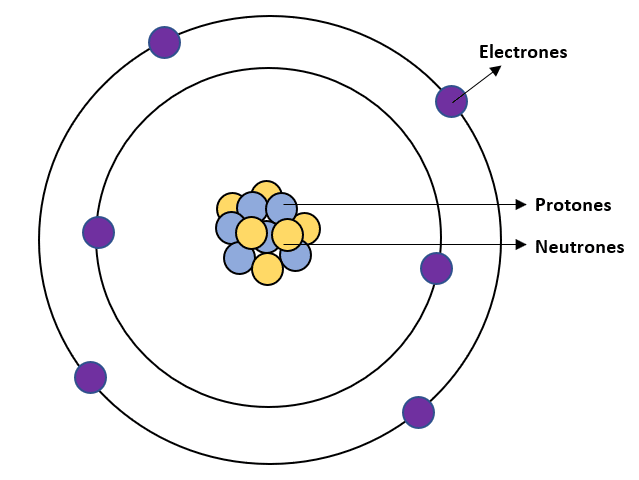
El carbono es uno de los elementos más importantes de la tabla periódica, ya que es la base de la vida en la Tierra. Es un elemento químico con símbolo C y número atómico 6. La composición del carbono está formada por electrones, protones y neutrones en su núcleo.
Los electrones del carbono
Los electrones son partículas subatómicas que giran alrededor del núcleo del átomo de carbono. Estos electrones tienen carga negativa y están organizados en capas o niveles de energía. El nivel más cercano al núcleo puede contener hasta dos electrones, mientras que los niveles posteriores pueden contener hasta ocho electrones.
En el caso del carbono, tiene seis electrones en su configuración electrónica. Esto significa que tiene dos electrones en su nivel más cercano al núcleo y cuatro electrones en su segundo nivel.
Los protones del carbono
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo de carbono. El número de protones en el núcleo determina el número atómico del elemento, que en el caso del carbono es 6.
Los neutrones del carbono
Los neutrones son partículas subatómicas sin carga eléctrica que se encuentran en el núcleo del átomo de carbono. A diferencia de los protones, los neutrones no tienen carga eléctrica, por lo que su presencia en el núcleo no afecta el número atómico del elemento. En el caso del carbono, tiene seis neutrones en su núcleo.
La importancia del carbono en la vida
El carbono es un elemento clave en la vida, ya que es un componente esencial de los compuestos orgánicos que forman los seres vivos, como los carbohidratos, las proteínas, los lípidos y los ácidos nucleicos. Estos compuestos orgánicos son la base de la estructura celular y del metabolismo de los seres vivos.
Estructura del carbono en los compuestos orgánicos
En los compuestos orgánicos, el carbono puede formar enlaces covalentes con otros átomos de carbono y con otros elementos como el hidrógeno, el oxígeno, el nitrógeno, el fósforo y el azufre. Estos enlaces covalentes permiten la formación de cadenas y anillos de carbono que dan lugar a una gran variedad de compuestos orgánicos.
Importancia del carbono en la fotosíntesis
La fotosíntesis es el proceso por el cual las plantas, algas y algunas bacterias producen compuestos orgánicos a partir de la energía solar y el dióxido de carbono. En este proceso, el carbono se combina con otros elementos para formar azúcares y otros compuestos orgánicos. La fotosíntesis es esencial para la vida en la Tierra, ya que es la base de la cadena alimentaria y produce el oxígeno que respiramos.
Tabla de la composición del carbono
A continuación, te presentamos una tabla con la composición del carbono:
| Partícula subatómica | Cantidad |
| --- | --- |
| Electrones | 6 |
| Protones | 6 |
| Neutrones | 6 |
Conclusión
El carbono es un elemento esencial para la vida en la Tierra, ya que es un componente esencial de los compuestos orgánicos que forman los seres vivos y es la base de la fotosíntesis. La composición del carbono está formada por electrones, protones y neutrones en su núcleo.
Preguntas frecuentes
1. ¿Cuántos electrones tiene el carbono?
El carbono tiene seis electrones en su configuración electrónica.
2. ¿Cuántos protones tiene el carbono?
El carbono tiene seis protones en su núcleo.
3. ¿Cuántos neutrones tiene el carbono?
El carbono tiene seis neutrones en su núcleo.
4. ¿Por qué es importante el carbono en la vida?
El carbono es importante en la vida porque es un componente esencial de los compuestos orgánicos que forman los seres vivos y es la base de la fotosíntesis.
5. ¿Cómo se combina el carbono en los compuestos orgánicos?
En los compuestos orgánicos, el carbono puede formar enlaces covalentes con otros átomos de carbono y con otros elementos como el hidrógeno, el oxígeno, el nitrógeno, el fósforo y el azufre.
Deja una respuesta