Descubre el sorprendente modelo atómico de Thomson
La ciencia ha avanzado a pasos agigantados en los últimos siglos, y uno de los campos más fascinantes es la física atómica. Los científicos han estudiado con detalle la estructura de los átomos, y uno de los modelos más sorprendentes es el modelo atómico de Thomson. En este artículo, descubriremos qué es el modelo atómico de Thomson, sus características y su impacto en la ciencia.
- ¿Qué es el modelo atómico de Thomson?
- Características del modelo atómico de Thomson
- Impacto del modelo atómico de Thomson en la ciencia
- Comparación con otros modelos atómicos
- Conclusión
- Preguntas frecuentes
- ¿Por qué Thomson pensó que los electrones estaban distribuidos uniformemente en la esfera?
- ¿Cómo influyó el modelo de Thomson en el desarrollo de la física atómica?
- ¿Por qué el modelo de Thomson ha sido reemplazado por modelos más precisos?
- ¿Qué importancia tiene el modelo atómico de Thomson en la actualidad?
- ¿Qué experimentos realizó Thomson para desarrollar su modelo atómico?
¿Qué es el modelo atómico de Thomson?
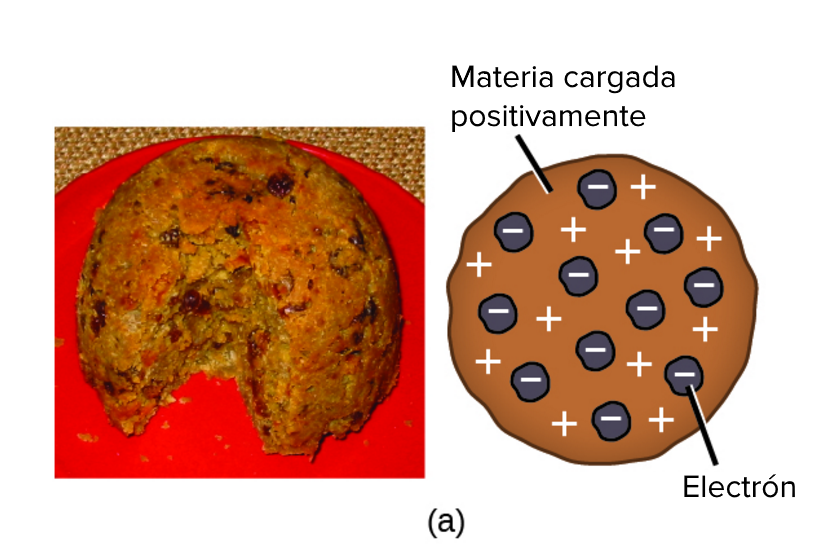
El modelo atómico de Thomson es un modelo que describe la estructura de los átomos. Fue propuesto por el científico británico J.J. Thomson en 1897. Según este modelo, los átomos están compuestos por una esfera de carga positiva, en la que se encuentran incrustados electrones de carga negativa.
Thomson basó su modelo en una serie de experimentos que realizó con tubos de rayos catódicos. En estos experimentos, Thomson observó que los rayos catódicos (un tipo de radiación) estaban compuestos por partículas mucho más pequeñas, a las que llamó "corpúsculos". Estos corpúsculos eran los electrones, y Thomson dedujo que si los electrones formaban parte de los rayos catódicos, también debían estar presentes en los átomos.
Características del modelo atómico de Thomson
El modelo atómico de Thomson tiene varias características importantes:
- Esfera de carga positiva: Según este modelo, los átomos tienen una esfera de carga positiva que contiene la mayor parte de la masa del átomo.
- Electrones: Los electrones están incrustados en la esfera de carga positiva, como si fueran pasas en un pudding. Thomson pensó que los electrones estaban distribuidos de forma uniforme en la esfera.
- Neutralidad del átomo: Aunque los electrones tienen carga negativa y la esfera de carga positiva tiene carga positiva, el átomo es eléctricamente neutro, ya que la carga positiva y negativa se cancelan.
Impacto del modelo atómico de Thomson en la ciencia
El modelo atómico de Thomson tuvo un gran impacto en la ciencia. En primer lugar, fue el primer modelo que describió la estructura interna de los átomos. Antes de Thomson, los científicos pensaban que los átomos eran indivisibles y que no tenían estructura interna.
Además, el modelo de Thomson proporcionó una base sólida para la investigación posterior sobre los átomos. Los científicos pudieron usar el modelo de Thomson para hacer predicciones sobre las propiedades de los átomos y para diseñar experimentos para probar estas predicciones.
Finalmente, el modelo atómico de Thomson allanó el camino para el desarrollo del modelo atómico de Bohr, que fue una mejora significativa sobre el modelo de Thomson.
Comparación con otros modelos atómicos
El modelo atómico de Thomson fue uno de los primeros modelos que describieron la estructura interna de los átomos. Sin embargo, ha sido reemplazado por modelos más precisos y completos.
El modelo atómico de Bohr, por ejemplo, describe los electrones en órbita alrededor del núcleo del átomo, en lugar de estar incrustados en una esfera de carga positiva. El modelo atómico de Schrödinger es aún más preciso y describe los electrones como ondas de probabilidad, en lugar de partículas.
Conclusión
El modelo atómico de Thomson fue un avance significativo en nuestra comprensión de la estructura de los átomos. Aunque ha sido reemplazado por modelos más precisos, sigue siendo un hito en la historia de la ciencia.
Preguntas frecuentes
¿Por qué Thomson pensó que los electrones estaban distribuidos uniformemente en la esfera?
Thomson pensó que los electrones estaban distribuidos uniformemente en la esfera porque no tenía evidencia para sugerir lo contrario. En aquel momento, no se sabía mucho sobre la estructura interna de los átomos, por lo que Thomson tuvo que hacer suposiciones basadas en sus observaciones.
¿Cómo influyó el modelo de Thomson en el desarrollo de la física atómica?
El modelo de Thomson proporcionó una base sólida para la investigación posterior sobre los átomos. Los científicos pudieron usar el modelo de Thomson para hacer predicciones sobre las propiedades de los átomos y para diseñar experimentos para probar estas predicciones.
¿Por qué el modelo de Thomson ha sido reemplazado por modelos más precisos?
El modelo de Thomson ha sido reemplazado por modelos más precisos porque no describía con precisión la estructura de los átomos. Los modelos más precisos, como el modelo atómico de Bohr y el modelo atómico de Schrödinger, describen con mayor precisión la estructura interna de los átomos y las propiedades de los electrones.
¿Qué importancia tiene el modelo atómico de Thomson en la actualidad?
Aunque ha sido reemplazado por modelos más precisos, el modelo atómico de Thomson sigue siendo un hito en la historia de la ciencia. Fue el primer modelo que describió la estructura interna de los átomos, lo que allanó el camino para la investigación posterior en la física atómica.
¿Qué experimentos realizó Thomson para desarrollar su modelo atómico?
Thomson realizó experimentos con tubos de rayos catódicos para desarrollar su modelo atómico. Observó que los rayos catódicos estaban compuestos por partículas mucho más pequeñas, a las que llamó "corpúsculos". Estos corpúsculos eran los electrones, y Thomson dedujo que si los electrones formaban parte de los rayos catódicos, también debían estar presentes en los átomos.
Deja una respuesta