Descubre el primer nivel de organización de la materia
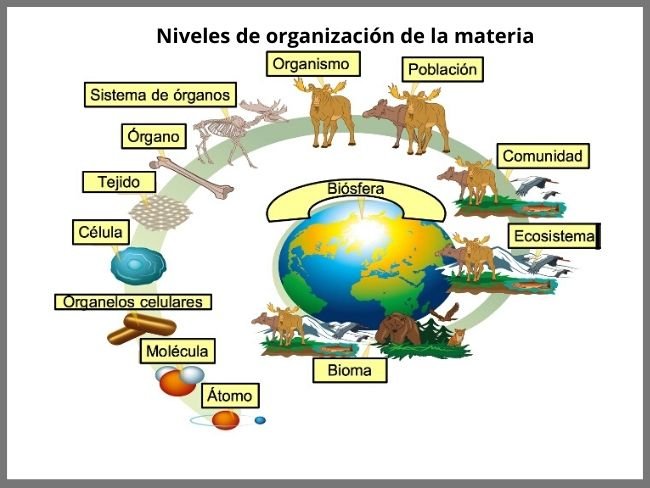
Cuando pensamos en la materia, probablemente imaginamos objetos sólidos y tangibles. Sin embargo, la materia está compuesta por pequeñas partículas invisibles a simple vista, que se organizan en diferentes niveles. El primer nivel de organización de la materia es el átomo.
¿Qué es un átomo?
Un átomo es la unidad básica de la materia. Está compuesto por un núcleo central, que contiene protones y neutrones, y electrones que orbitan alrededor del núcleo. Los protones tienen carga positiva, los electrones tienen carga negativa y los neutrones no tienen carga eléctrica.
¿Cómo se descubrió el átomo?
Se cree que la idea del átomo se originó en la antigua Grecia. Sin embargo, fue hasta el siglo XIX que se comenzó a entender su estructura y composición. En 1913, el físico danés Niels Bohr propuso un modelo atómico que describía cómo los electrones se organizan en diferentes niveles de energía alrededor del núcleo.
¿Cuál es la importancia del átomo?
El átomo es importante porque es la base de la química y la física. Nos permite entender cómo se combinan los elementos para formar compuestos y cómo interactúan los materiales a nivel molecular. Además, el conocimiento del átomo ha llevado al desarrollo de tecnologías como la energía nuclear y la electrónica.
Tabla periódica de los elementos
Para entender mejor la estructura del átomo, es útil tener en cuenta la tabla periódica de los elementos. Esta tabla muestra todos los elementos químicos conocidos y su disposición en función de su número atómico. El número atómico es la cantidad de protones en el núcleo del átomo.
Partes del átomo
Además del núcleo y los electrones, existen otras partículas subatómicas que componen el átomo. Estas incluyen los quarks, que son los componentes más pequeños de los protones y neutrones, y los neutrinos, que son partículas sin carga eléctrica que interactúan muy débilmente con la materia.
Isótopos
Los isótopos son átomos de un mismo elemento que tienen diferentes números de neutrones en su núcleo. Esto significa que tienen el mismo número atómico, pero diferente masa atómica. Los isótopos pueden ser estables o inestables, lo que significa que pueden emitir radiación en forma de partículas o energía.
Iones
Cuando un átomo pierde o gana electrones, se convierte en un ion. Los iones tienen carga eléctrica y pueden ser positivos o negativos. Por ejemplo, un átomo de sodio (Na) que pierde un electrón se convierte en un ion Na+.
Moléculas
Las moléculas son la combinación de dos o más átomos unidos mediante enlaces químicos. Estos enlaces se forman cuando los átomos comparten electrones en su capa más externa. Las moléculas pueden ser simples, como el agua (H2O), o complejas, como las proteínas y los ácidos nucleicos.
Conclusión
El átomo es la unidad básica de la materia y el primer nivel de organización. Comprender su estructura y composición es esencial para entender la química y la física, así como para desarrollar tecnologías avanzadas. La tabla periódica de los elementos es una herramienta útil para visualizar la disposición de los átomos en la naturaleza.
Preguntas frecuentes
¿Qué es el número atómico?
El número atómico es la cantidad de protones en el núcleo del átomo.
¿Qué es un isótopo?
Un isótopo es un átomo de un mismo elemento que tiene diferentes números de neutrones en su núcleo.
¿Qué son los iones?
Los iones son átomos que han perdido o ganado electrones y tienen carga eléctrica.
¿Qué son las moléculas?
Las moléculas son la combinación de dos o más átomos unidos mediante enlaces químicos.
¿Qué es la tabla periódica de los elementos?
La tabla periódica de los elementos es una herramienta que muestra todos los elementos químicos conocidos y su disposición en función de su número atómico.
Deja una respuesta