Descubre el estado de oxidación en la tabla periódica
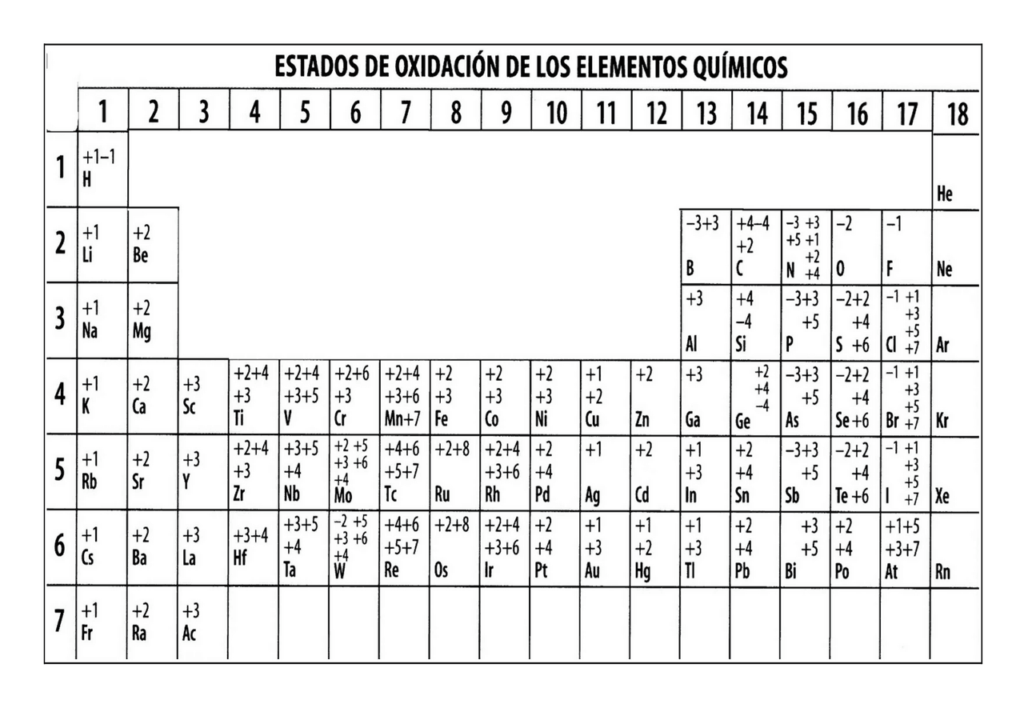
La tabla periódica es una herramienta indispensable para cualquier estudiante de química. En ella, se encuentran organizados todos los elementos químicos conocidos de acuerdo a su número atómico y sus propiedades. Uno de los datos más importantes de los elementos es su estado de oxidación, que es un número que indica la cantidad de electrones que un átomo ha ganado o perdido en una reacción química. En este artículo, te explicaremos cómo se determina el estado de oxidación y cómo se representa en la tabla periódica.
¿Qué es el estado de oxidación?
El estado de oxidación (también conocido como número de oxidación) es un número que indica la cantidad de electrones que un átomo ha ganado o perdido en una reacción química. Los elementos químicos pueden tener diferentes estados de oxidación dependiendo de la reacción a la que estén sometidos. Por ejemplo, el hierro puede tener un estado de oxidación de +2 o +3, dependiendo de la reacción química en la que participe.
¿Cómo se determina el estado de oxidación?
El estado de oxidación se determina a través de una serie de reglas establecidas por la IUPAC (Unión Internacional de Química Pura y Aplicada). Estas reglas se basan en el concepto de que los elementos tienden a ganar o perder electrones para alcanzar el estado de configuración electrónica de un gas noble (los elementos de la última columna de la tabla periódica).
En general, los metales tienden a perder electrones para formar cationes (iones con carga positiva), mientras que los no metales tienden a ganar electrones para formar aniones (iones con carga negativa). A partir de esta premisa, se establecen una serie de reglas para determinar el estado de oxidación de un elemento en una reacción química.
Reglas para determinar el estado de oxidación
1. El estado de oxidación de un elemento en su estado elemental (no combinado con otros elementos) es siempre cero.
2. El estado de oxidación de un ion monoatómico es igual a su carga. Por ejemplo, el estado de oxidación del ion sodio (Na+) es +1.
3. El estado de oxidación del oxígeno en la mayoría de los compuestos es -2. Excepciones son los peróxidos (como el peróxido de hidrógeno, H2O2) en los que el estado de oxidación del oxígeno es -1.
4. El estado de oxidación del hidrógeno en la mayoría de los compuestos es +1. Excepciones son los hidruros metálicos (como el hidruro de sodio, NaH) en los que el estado de oxidación del hidrógeno es -1.
5. El estado de oxidación de los halógenos (fluor, cloro, bromo, yodo) en la mayoría de los compuestos es -1. Excepciones son en los que el halógeno es combinado con un elemento más electronegativo.
6. La suma de los estados de oxidación de todos los átomos en una molécula es igual a cero, y en un ion es igual a la carga del ion.
Representación del estado de oxidación en la tabla periódica
En la tabla periódica, el estado de oxidación se representa mediante números romanos en los paréntesis que se encuentran después del símbolo del elemento. Por ejemplo, el hierro (Fe) tiene dos estados de oxidación comunes: +2 y +3. Estos se representan en la tabla periódica como Fe(II) y Fe(III), respectivamente.
Aplicaciones del estado de oxidación
El estado de oxidación es un dato muy importante en química, ya que permite predecir la dirección y el resultado de una reacción química. Además, es útil para determinar la fórmula química de un compuesto, ya que la suma de los estados de oxidación de todos los átomos en una molécula es igual a cero.
Ejemplo de aplicación del estado de oxidación
Supongamos que queremos determinar la fórmula química de un compuesto que contiene hierro y oxígeno. Sabemos que el estado de oxidación del oxígeno es -2 y que el hierro puede tener un estado de oxidación de +2 o +3. Para determinar la fórmula química, tenemos que igualar la suma de los estados de oxidación de los átomos con cero.
Si el hierro tiene un estado de oxidación de +2, necesitamos dos átomos de hierro y tres átomos de oxígeno para igualar los estados de oxidación: Fe(II)2O3. Si el hierro tiene un estado de oxidación de +3, necesitamos un átomo de hierro y dos átomos de oxígeno: Fe(III)O2.
Conclusión
El estado de oxidación es un dato muy importante en química, ya que permite predecir la dirección y el resultado de una reacción química. Se determina a través de una serie de reglas establecidas por la IUPAC, y se representa en la tabla periódica mediante números romanos. Además, es útil para determinar la fórmula química de un compuesto, ya que la suma de los estados de oxidación de todos los átomos en una molécula es igual a cero.
Preguntas frecuentes
1. ¿Qué es el estado de oxidación?
El estado de oxidación es un número que indica la cantidad de electrones que un átomo ha ganado o perdido en una reacción química.
2. ¿Cómo se determina el estado de oxidación?
El estado de oxidación se determina a través de una serie de reglas establecidas por la IUPAC, que se basan en el concepto de que los elementos tienden a ganar o perder electrones para alcanzar el estado de configuración electrónica de un gas noble.
3. ¿Cómo se representa el estado de oxidación en la tabla periódica?
El estado de oxidación se representa mediante números romanos en los paréntesis que se encuentran después del símbolo del elemento.
4. ¿Para qué sirve el estado de oxidación?
El estado de oxidación es útil para predecir la dirección y el resultado de una reacción química, así como para determinar la fórmula química de un compuesto.
5. ¿Qué elementos tienen un estado de oxidación fijo?
Los elementos de la última columna de la tabla periódica (los gases nobles) tienen un estado de oxidación fijo de cero, ya que tienen configuración electrónica completa.
Deja una respuesta