Descubre cuántos electrones necesita el sodio para formar su ion
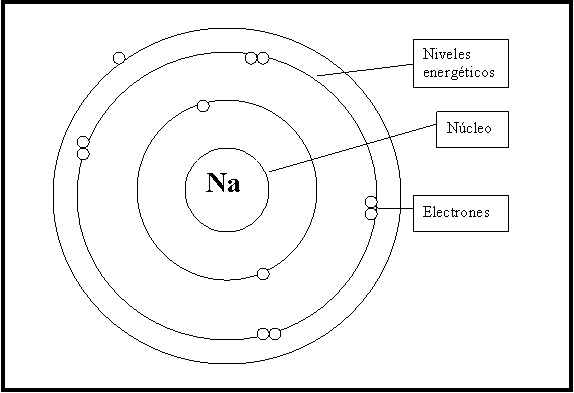
El sodio (Na) es un elemento químico muy común que se encuentra en la naturaleza en forma de sales. Su átomo tiene 11 electrones y se encuentra en el grupo 1 de la tabla periódica, lo que significa que tiene un solo electrón en su capa externa. Para alcanzar la estabilidad, el sodio necesita perder ese electrón y formar un ion positivo (Na+).
Pero, ¿cuántos electrones necesita exactamente el sodio para formar su ion? La respuesta es simple: uno solo. Al perder ese electrón de su capa externa, el sodio alcanza la configuración electrónica del gas noble más cercano, que en este caso es el neón (Ne). El neón tiene 10 electrones y su capa externa está completamente llena, por lo que es un gas noble muy estable.
Al perder un electrón, el sodio se convierte en un ion positivo con una carga eléctrica de +1. Esto significa que tiene un electrón menos que su átomo neutro y, por lo tanto, su número atómico es ahora de 10. El ion de sodio (Na+) es muy importante en la química y en la biología, ya que participa en muchas reacciones químicas y es esencial para el funcionamiento de las células y los tejidos del cuerpo humano.
El sodio necesita perder un solo electrón para formar su ion positivo (Na+). Este proceso le permite alcanzar la estabilidad y adquirir la configuración electrónica del gas noble más cercano, el neón. Ahora que sabes cuántos electrones necesita el sodio para formar su ion, veamos algunas preguntas frecuentes sobre este tema.
Preguntas frecuentes
¿Por qué el sodio quiere perder un electrón?
El sodio quiere perder un electrón porque esto le permite alcanzar la estabilidad y adquirir la configuración electrónica del gas noble más cercano, el neón. Los gases nobles son muy estables porque su capa externa está completamente llena de electrones, lo que los hace poco reactivos y poco propensos a formar compuestos químicos. Al perder un electrón, el sodio se convierte en un ion positivo que tiene una carga eléctrica de +1 y que es más estable que su átomo neutro.
¿Qué sucede cuando el sodio pierde más de un electrón?
Cuando el sodio pierde más de un electrón, forma iones positivos con cargas eléctricas mayores que +1. Por ejemplo, si pierde dos electrones, forma el ion Na2+, que tiene una carga eléctrica de +2. Si pierde tres electrones, forma el ion Na3+, que tiene una carga eléctrica de +3. Estos iones son menos estables que el ion Na+ y son más reactivos, lo que significa que pueden participar en reacciones químicas más complejas.
¿Qué es la electronegatividad?
La electronegatividad es una propiedad de los elementos químicos que indica su capacidad para atraer electrones hacia sí mismos en una molécula o un compuesto. Los elementos más electronegativos son los que tienen una mayor afinidad por los electrones y los atraen con más fuerza. En la tabla periódica, la electronegatividad aumenta de izquierda a derecha y de abajo hacia arriba. El flúor es el elemento más electronegativo de la tabla periódica, mientras que el cesio es el menos electronegativo.
¿Por qué el sodio es un metal?
El sodio es un metal porque tiene las propiedades típicas de los metales, como ser buen conductor de la electricidad y el calor, ser maleable y tener un brillo metálico. Los metales son elementos químicos que tienen una estructura cristalina en la que los átomos están unidos por enlaces metálicos, que son enlaces fuertes entre los núcleos de los átomos y los electrones que se mueven libremente en la estructura cristalina. El sodio es un metal blando y plateado que se oxida rápidamente en presencia de aire y agua.
¿Qué es un ion?
Un ion es un átomo o una molécula que ha perdido o ganado electrones y, por lo tanto, tiene una carga eléctrica positiva o negativa. Los iones positivos se llaman cationes y los iones negativos se llaman aniones. Los iones son muy importantes en la química y en la biología, ya que participan en muchas reacciones químicas y son esenciales para el funcionamiento de las células y los tejidos del cuerpo humano.
Deja una respuesta