Descubre cómo los átomos se unen: la ciencia de los enlaces químicos
Los átomos son la base de la materia. Todo lo que nos rodea está compuesto por átomos. Estos pequeños bloques de construcción se unen para formar moléculas y compuestos, que son la base de la química. Pero, ¿cómo se unen los átomos? La respuesta radica en la ciencia de los enlaces químicos.
Los enlaces químicos son la fuerza que mantiene unidos a los átomos en una molécula o compuesto. Hay varios tipos de enlaces químicos, cada uno con sus propiedades únicas. En este artículo, exploraremos los diferentes tipos de enlaces químicos y cómo afectan a la materia que nos rodea.
Enlaces iónicos
Los enlaces iónicos son el resultado de la transferencia de electrones entre dos átomos. En este tipo de enlace, un átomo pierde electrones para convertirse en un ion positivo, mientras que otro átomo gana electrones para convertirse en un ion negativo. Los iones opuestos se atraen entre sí y se unen para formar un compuesto.
Un ejemplo de enlace iónico es el cloruro de sodio, también conocido como sal de mesa. El cloruro de sodio se forma a partir de los iones de sodio y cloruro, que se unen para formar cristales de sal. Los enlaces iónicos son típicamente fuertes y requieren mucha energía para romperse.
Enlaces covalentes
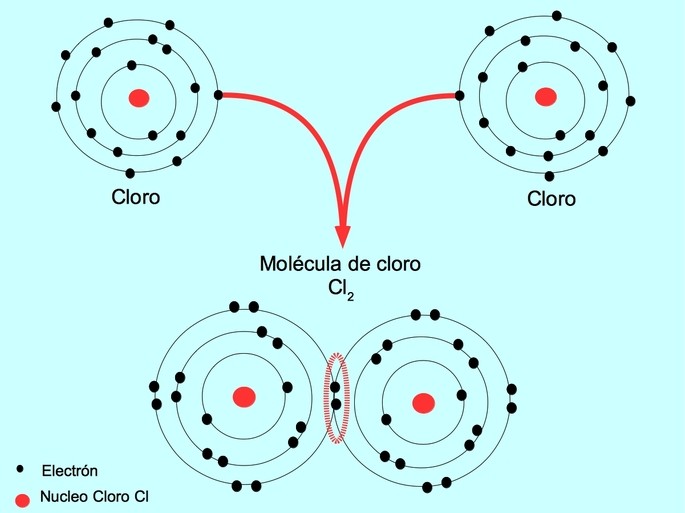
Los enlaces covalentes se forman cuando dos o más átomos comparten electrones. En un enlace covalente, los átomos comparten electrones para formar una molécula estable. Los enlaces covalentes se dividen en enlaces covalentes simples, dobles y triples, según la cantidad de electrones compartidos.
Un ejemplo de enlace covalente es el agua, H2O. Los átomos de hidrógeno comparten sus electrones con el átomo de oxígeno para formar una molécula de agua estable. Los enlaces covalentes son típicamente más débiles que los enlaces iónicos, pero aún así son lo suficientemente fuertes como para mantener unidos a los átomos.
Enlaces metálicos
Los enlaces metálicos son únicos en que involucran la unión de muchos átomos en una estructura sólida. En un enlace metálico, los átomos de metal comparten sus electrones en una nube de electrones que rodea a los iones positivos. Esta estructura sólida es lo que da a los metales sus propiedades únicas, como la conductividad eléctrica y térmica.
Un ejemplo de enlace metálico es el cobre, que está formado por una red de átomos de cobre unidos por enlaces metálicos. Los enlaces metálicos son típicamente fuertes y tienen una alta conductividad eléctrica y térmica.
Enlaces de hidrógeno
Los enlaces de hidrógeno son una forma especial de enlace covalente que se encuentra en moléculas polares. En un enlace de hidrógeno, el átomo de hidrógeno en una molécula polar se une a un átomo de otra molécula polar. Los enlaces de hidrógeno son importantes en la formación de moléculas biológicas, como el ADN y las proteínas.
Un ejemplo de enlace de hidrógeno es el agua, H2O. Los átomos de hidrógeno en una molécula de agua se unen a los átomos de oxígeno de otras moléculas de agua a través de enlaces de hidrógeno. Los enlaces de hidrógeno son típicamente más débiles que los enlaces covalentes o iónicos.
Conclusión
La ciencia de los enlaces químicos es la base de la química y la vida misma. Los enlaces químicos son la fuerza que une a los átomos para formar moléculas y compuestos. Hay varios tipos de enlaces químicos, cada uno con sus propiedades únicas. Los enlaces iónicos son el resultado de la transferencia de electrones, los enlaces covalentes son el resultado de la compartición de electrones, los enlaces metálicos involucran la unión de muchos átomos en una estructura sólida, y los enlaces de hidrógeno son una forma especial de enlace covalente que se encuentra en moléculas polares.
Preguntas frecuentes
¿Cuál es el enlace químico más fuerte?
El enlace químico más fuerte es el enlace covalente triple, en el que tres pares de electrones son compartidos entre dos átomos.
¿Qué es un enlace polar?
Un enlace polar es un tipo de enlace covalente en el que los electrones no se comparten uniformemente entre los átomos. Esto resulta en una molécula con una carga parcial positiva en un extremo y una carga parcial negativa en el otro extremo.
¿Por qué los metales son buenos conductores eléctricos?
Los metales son buenos conductores eléctricos debido a la estructura de sus enlaces metálicos. Los electrones se comparten en una nube de electrones que rodea a los iones positivos, lo que permite que la electricidad fluya libremente a través del metal.
¿Qué son los enlaces de hidrógeno y por qué son importantes?
Los enlaces de hidrógeno son una forma especial de enlace covalente que se encuentra en moléculas polares. Los enlaces de hidrógeno son importantes en la formación de moléculas biológicas, como el ADN y las proteínas.
¿Qué es la electronegatividad y cómo afecta a los enlaces químicos?
La electronegatividad es la medida de la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. La electronegatividad afecta a los enlaces químicos al determinar si un enlace será covalente o iónico. Si hay una gran diferencia en la electronegatividad entre dos átomos, el enlace será iónico. Si la electronegatividad es similar, el enlace será covalente.
Deja una respuesta