Descubre cómo calcular la masa atómica de un elemento fácilmente
La masa atómica es un concepto fundamental en la química que se utiliza para medir la masa de los átomos de un elemento en comparación con la masa de los átomos de otros elementos. Aprender a calcular la masa atómica de un elemento puede ser una tarea intimidante, pero en realidad es bastante sencillo si se sigue una serie de pasos simples. En este artículo, te explicamos cómo calcular la masa atómica de un elemento fácilmente.
¿Qué es la masa atómica?
La masa atómica de un elemento es la masa promedio de un átomo de ese elemento. Se expresa en unidades de masa atómica (u), que es una unidad de medida que equivale a 1/12 de la masa del átomo de carbono-12. La masa atómica de un elemento se calcula sumando las masas de los protones y los neutrones en el núcleo de un átomo y dividiendo el resultado por el número de átomos en la muestra.
Paso 1: Determina el número de protones y neutrones
El número de protones en el núcleo de un átomo se conoce como número atómico y se representa por la letra Z. Para calcular el número de neutrones en un átomo, se resta el número atómico del número de masa. El número de masa es la suma del número de protones y neutrones en el núcleo de un átomo y se representa por la letra A. Por ejemplo, si un átomo tiene un número atómico de 6 y un número de masa de 12, entonces tiene 6 protones y 6 neutrones (12-6=6).
Paso 2: Determina la abundancia de cada isótopo
La mayoría de los elementos tienen más de un isótopo, lo que significa que tienen diferentes números de neutrones en sus núcleos. La abundancia de cada isótopo se expresa como un porcentaje del total de átomos de ese elemento en una muestra. Para calcular la masa atómica de un elemento, es necesario conocer la abundancia de cada isótopo y su masa.
Paso 3: Calcula la masa atómica promedio
Para calcular la masa atómica promedio de un elemento, se multiplica la masa de cada isótopo por su abundancia relativa y se suma el resultado. La fórmula para calcular la masa atómica promedio es la siguiente:
Masa atómica promedio = (masa del isótopo 1 x abundancia relativa del isótopo 1) + (masa del isótopo 2 x abundancia relativa del isótopo 2) + ...
Por ejemplo, si un elemento tiene dos isótopos, uno con una masa de 10 u y una abundancia del 20%, y otro con una masa de 12 u y una abundancia del 80%, la masa atómica promedio se calcularía de la siguiente manera:
Masa atómica promedio = (10 u x 0.2) + (12 u x 0.8) = 10.4 u
Ejemplo práctico
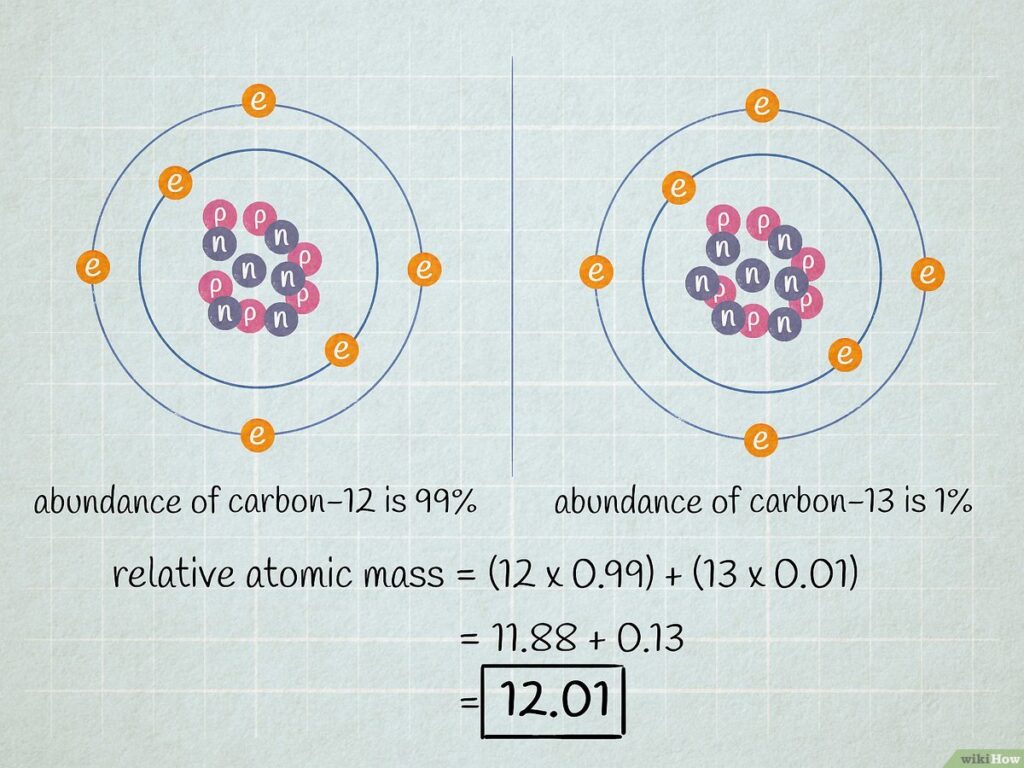
Supongamos que queremos calcular la masa atómica del carbono. El carbono tiene dos isótopos naturales: el carbono-12, que tiene una masa de 12 u y una abundancia del 98.93%, y el carbono-13, que tiene una masa de 13 u y una abundancia del 1.07%.
Para calcular la masa atómica promedio del carbono, se utiliza la fórmula anterior:
Masa atómica promedio del carbono = (12 u x 0.9893) + (13 u x 0.0107) = 12.01 u
Por lo tanto, la masa atómica del carbono es de 12.01 u.
Conclusión
Calcular la masa atómica de un elemento puede parecer complicado, pero si se siguen los pasos correctos, es un proceso sencillo. Aprender a calcular la masa atómica de un elemento es importante para entender la química y la física de los elementos y sus reacciones.
Preguntas frecuentes
¿Cuál es la unidad de medida de la masa atómica?
La unidad de medida de la masa atómica es la unidad de masa atómica (u), que es una unidad de medida que equivale a 1/12 de la masa del átomo de carbono-12.
¿Cómo se calcula el número de neutrones en un átomo?
Para calcular el número de neutrones en un átomo, se resta el número atómico del número de masa. El número de masa es la suma del número de protones y neutrones en el núcleo de un átomo y se representa por la letra A.
¿Cómo se determina la abundancia de un isótopo?
La abundancia de un isótopo se expresa como un porcentaje del total de átomos de ese elemento en una muestra.
¿Por qué es importante calcular la masa atómica de un elemento?
Calcular la masa atómica de un elemento es importante para entender la química y la física de los elementos y sus reacciones.
¿Por qué algunos elementos tienen más de un isótopo?
Algunos elementos tienen más de un isótopo porque tienen diferentes números de neutrones en sus núcleos.
Deja una respuesta