De Demócrito a Bohr: la evolución de los modelos atómicos en una línea de tiempo
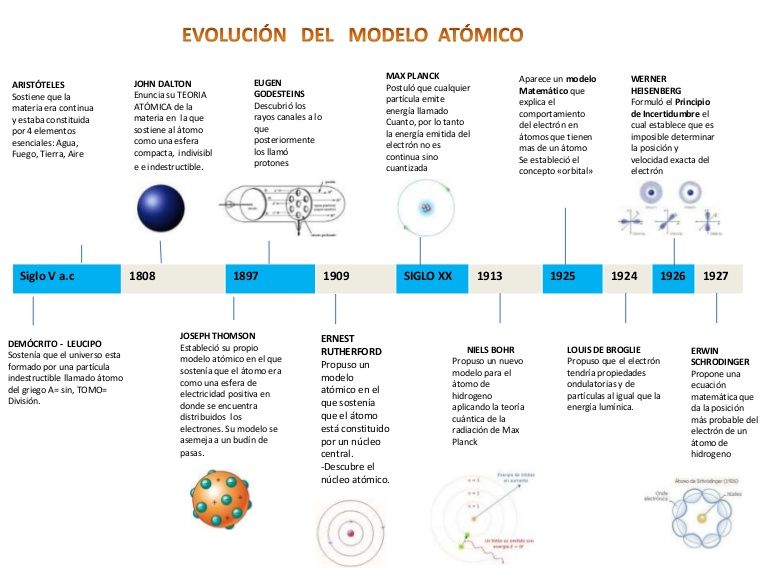
Desde la antigua Grecia hasta la era moderna, el concepto de átomo ha sido una parte fundamental de la ciencia y la física. Los modelos atómicos han evolucionado a lo largo de la historia, desde las teorías iniciales de Demócrito hasta el modelo de Bohr.
En este artículo, exploraremos la evolución de los modelos atómicos a lo largo del tiempo y cómo cada uno de ellos ha contribuido a nuestra comprensión actual de la estructura atómica.
El modelo de Demócrito
En el siglo V a.C., el filósofo griego Demócrito propuso que la materia estaba compuesta por pequeñas partículas indivisibles llamadas átomos. Esta teoría sugirió que todos los objetos estaban compuestos por átomos que se unían para formar la materia. Demócrito creía que los átomos eran diferentes en forma y tamaño, y que se unían en diferentes combinaciones para formar diferentes sustancias.
El modelo de Dalton
En el siglo XIX, el químico británico John Dalton desarrolló el modelo atómico de la esfera. Dalton argumentó que los átomos eran esferas sólidas e indivisibles y que diferentes elementos estaban compuestos de átomos con diferentes pesos atómicos. Este modelo también sugirió que los átomos se combinaban para formar moléculas.
El modelo de Thomson
En 1897, el físico británico J.J. Thomson descubrió el electrón y desarrolló el modelo del pastel de pasas. Este modelo propuso que los átomos consistían en una bola de carga positiva con electrones incrustados en ella, como pasas en un pastel. Este modelo también sugirió que los electrones y la carga positiva se equilibraban para mantener el átomo estable.
El modelo de Rutherford
En 1911, el físico neozelandés Ernest Rutherford realizó un experimento que demostró que los átomos tenían un núcleo central. El modelo atómico de Rutherford propuso que los átomos consistían en un núcleo central pequeño y denso con electrones orbitando alrededor del núcleo. Este modelo también sugirió que la mayoría del átomo era espacio vacío.
El modelo de Bohr
En 1913, el físico danés Niels Bohr desarrolló el modelo atómico de Bohr. Este modelo propuso que los electrones orbitaban alrededor del núcleo en diferentes niveles de energía. Este modelo también sugirió que los electrones podían saltar entre niveles de energía, lo que explica la emisión y absorción de luz por los átomos.
El modelo actual
El modelo atómico actual se basa en la teoría cuántica y la mecánica cuántica. Este modelo propone que los electrones no orbitan alrededor del núcleo en órbitas definidas, sino que se encuentran en nubes de probabilidad alrededor del núcleo. Este modelo también sugiere que los electrones pueden tener propiedades de onda y partícula al mismo tiempo.
Conclusión
La evolución de los modelos atómicos ha sido un proceso continuo a lo largo de la historia. Desde los primeros modelos de Demócrito hasta el modelo actual basado en la teoría cuántica, cada modelo ha contribuido a nuestra comprensión actual de la estructura atómica. Cada modelo ha sido un paso importante en el camino hacia una comprensión más completa de la naturaleza de la materia.
Preguntas frecuentes
1. ¿Qué es un átomo?
Un átomo es la unidad básica de la materia. Consiste en un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan alrededor del núcleo.
2. ¿Cuál es el modelo atómico actual?
El modelo atómico actual se basa en la teoría cuántica y la mecánica cuántica. Propone que los electrones se encuentran en nubes de probabilidad alrededor del núcleo y que pueden tener propiedades de onda y partícula al mismo tiempo.
3. ¿Cuándo se descubrió el electrón?
El electrón fue descubierto por J.J. Thomson en 1897.
4. ¿Qué es el modelo del pastel de pasas?
El modelo del pastel de pasas, desarrollado por J.J. Thomson, propone que los átomos consisten en una bola de carga positiva con electrones incrustados en ella, como pasas en un pastel.
5. ¿Quién propuso el modelo atómico de la esfera?
El modelo atómico de la esfera fue propuesto por John Dalton en el siglo XIX.
Deja una respuesta