Clasificación de enlaces químicos: cuadro sinóptico completo
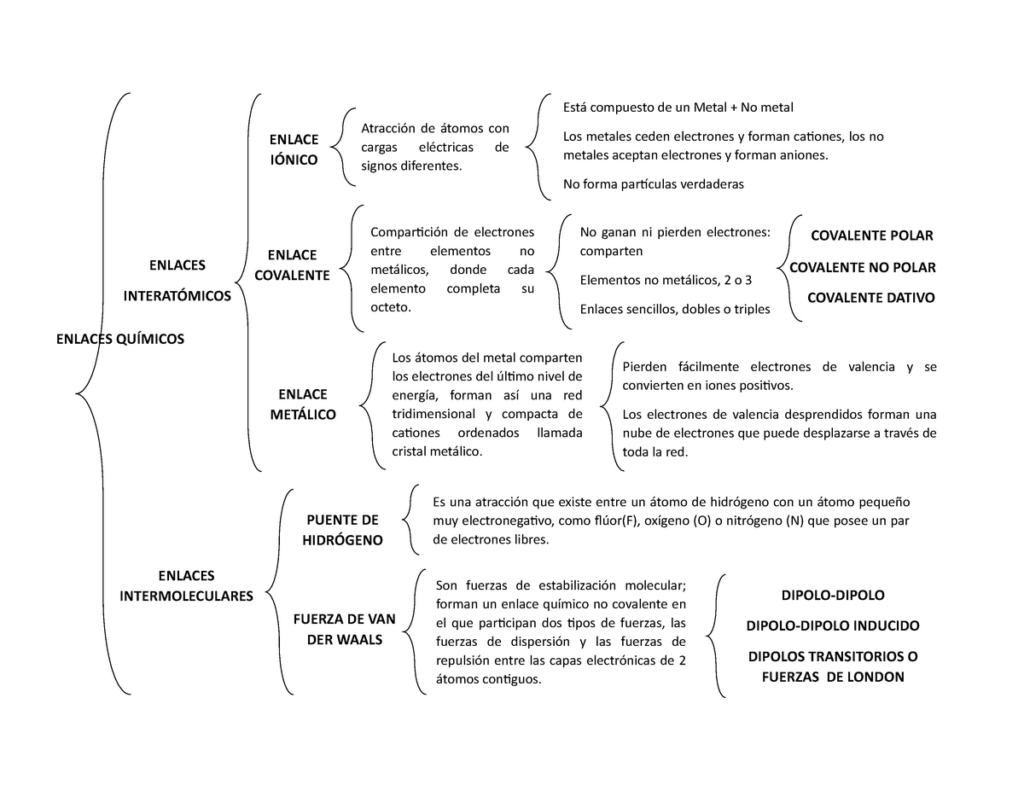
Los enlaces químicos son los que unen los átomos de los elementos para formar moléculas y compuestos. Estos enlaces pueden clasificarse en tres tipos principales: enlaces iónicos, enlaces covalentes y enlaces metálicos. En este artículo, te presentamos un cuadro sinóptico completo que resume las características y propiedades de cada uno de estos tipos de enlaces.
Enlaces iónicos
Los enlaces iónicos se forman entre átomos con diferencias significativas en su electronegatividad, lo que resulta en la transferencia de electrones de un átomo a otro. Los átomos que pierden electrones se convierten en iones positivos, o cationes, mientras que los átomos que ganan electrones se convierten en iones negativos, o aniones. Estos iones se atraen mutuamente debido a sus cargas opuestas, formando un enlace iónico.
Características:
- Los enlaces iónicos se forman entre átomos de elementos metálicos y no metálicos.
- Son enlaces fuertes y tienen una alta energía de enlace.
- Los compuestos iónicos tienen altos puntos de fusión y ebullición debido a la fuerte atracción entre los iones.
- Los compuestos iónicos son sólidos cristalinos a temperatura ambiente.
- Los compuestos iónicos son solubles en agua y otros solventes polares.
Enlaces covalentes
Los enlaces covalentes se forman cuando los átomos comparten electrones en lugar de transferirlos. Los átomos que comparten electrones se unen para formar una molécula. Los enlaces covalentes pueden ser simples, dobles o triples dependiendo del número de electrones compartidos.
Características:
- Los enlaces covalentes se forman entre átomos de elementos no metálicos.
- Son enlaces fuertes y tienen una alta energía de enlace.
- Los compuestos covalentes tienen puntos de fusión y ebullición más bajos que los compuestos iónicos debido a la menor fuerza de atracción entre las moléculas.
- Los compuestos covalentes pueden ser sólidos, líquidos o gases a temperatura ambiente.
- Los compuestos covalentes son solubles en solventes no polares.
Enlaces metálicos
Los enlaces metálicos se forman entre átomos de elementos metálicos. En los metales, los átomos pierden electrones de sus capas externas y forman una red tridimensional de iones positivos en un mar de electrones libres. Estos electrones libres se mueven libremente a través de la estructura metálica, lo que les da a los metales sus propiedades únicas.
Características:
- Los enlaces metálicos se forman entre átomos de elementos metálicos.
- Son enlaces fuertes y tienen una alta energía de enlace.
- Los metales tienen altos puntos de fusión y ebullición debido a la fuerte atracción entre los iones positivos y los electrones libres.
- Los metales son sólidos a temperatura ambiente.
- Los metales son buenos conductores de electricidad y calor debido a la capacidad de los electrones libres para moverse libremente.
Resumen
Tipo de enlace | Átomos involucrados | Energía de enlace | Puntos de fusión y ebullición | Estado a temperatura ambiente | Solubilidad
--- | --- | --- | --- | --- | ---
Enlace iónico | Elementos metálicos y no metálicos | Alta | Altos | Sólido cristalino | Soluble en agua y solventes polares
Enlace covalente | Elementos no metálicos | Alta | Bajos | Sólido, líquido o gas | Soluble en solventes no polares
Enlace metálico | Elementos metálicos | Alta | Altos | Sólido | No soluble
Preguntas frecuentes
1. ¿Qué es un enlace químico?
Un enlace químico es la fuerza que mantiene unidos los átomos de los elementos para formar moléculas y compuestos.
2. ¿Cómo se forman los enlaces iónicos?
Los enlaces iónicos se forman cuando los átomos de elementos metálicos transfieren electrones a los átomos de elementos no metálicos.
3. ¿Qué es un enlace covalente simple?
Un enlace covalente simple es un enlace en el que dos átomos comparten un par de electrones.
4. ¿Qué es un enlace metálico?
Un enlace metálico es un enlace entre átomos de elementos metálicos en el que los átomos pierden electrones de sus capas externas para formar una red tridimensional de iones positivos en un mar de electrones libres.
5. ¿Por qué los metales son buenos conductores de electricidad?
Los metales son buenos conductores de electricidad debido a la capacidad de los electrones libres para moverse libremente a través de la estructura metálica.
Deja una respuesta