Clasificación de elementos químicos: sólido, líquido y gas
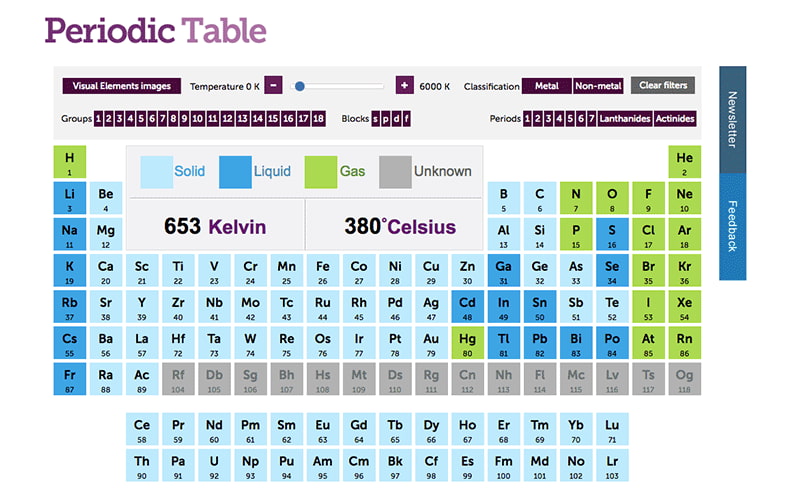
Cuando hablamos de elementos químicos, una de las formas más comunes de clasificarlos es según su estado físico: sólido, líquido o gas. Esta clasificación se basa en las propiedades físicas de los elementos y está determinada por factores como la temperatura y la presión. En este artículo, exploraremos las características de cada uno de estos estados físicos y algunos ejemplos de elementos que se encuentran en cada categoría.
Sólidos
Los sólidos son aquellos elementos que tienen una forma y un volumen definidos y no se comprimen fácilmente. Las moléculas de los sólidos se mantienen juntas debido a las fuerzas de atracción intermoleculares y vibran en su lugar sin moverse demasiado. Los sólidos pueden ser cristalinos o amorfos, lo que significa que su estructura interna puede ser ordenada o desordenada, respectivamente.
Algunos ejemplos de elementos sólidos son el hierro, la plata, el oro y el carbón. También hay sólidos compuestos, como la sal de mesa, el azúcar y el vidrio.
Líquidos
Los líquidos son aquellos elementos que tienen un volumen definido pero no una forma definida. Los líquidos pueden fluir y tomar la forma del recipiente en el que se encuentran. Las moléculas de los líquidos están más separadas que las de los sólidos y tienen más energía cinética, lo que les permite moverse con mayor libertad.
Algunos ejemplos de elementos líquidos son el agua, el alcohol, el aceite y la gasolina.
Gases
Los gases son aquellos elementos que no tienen una forma ni un volumen definidos. Los gases pueden expandirse para llenar el espacio disponible y se comprimen fácilmente. Las moléculas de los gases están muy separadas y tienen mucha energía cinética, lo que les permite moverse con gran libertad.
Algunos ejemplos de elementos gaseosos son el oxígeno, el nitrógeno, el dióxido de carbono y el helio.
¿Cómo se puede cambiar el estado físico de los elementos?
Los elementos pueden cambiar de estado físico cuando se les somete a cambios de temperatura y/o presión. Por ejemplo, si se calienta un sólido, sus moléculas adquieren más energía cinética y pueden comenzar a moverse con más libertad, lo que puede hacer que se derrita y se convierta en un líquido. Si se sigue calentando ese líquido, sus moléculas adquieren aún más energía y pueden comenzar a evaporarse y convertirse en un gas.
Por otro lado, si se enfría un gas, sus moléculas pierden energía cinética y se mueven con menos libertad, lo que puede hacer que se condensen y se conviertan en un líquido. Si se sigue enfriando ese líquido, sus moléculas pierden aún más energía y se mueven aún menos, lo que puede hacer que se solidifique y se convierta en un sólido.
Tabla de elementos químicos según su estado físico
A continuación, se presenta una tabla de algunos elementos químicos clasificados según su estado físico:
| Sólidos | Líquidos | Gases |
|---|---|---|
| Hierro | Agua | Oxígeno |
| Plata | Mercurio | Nitrógeno |
| Oro | Alcohol | Dióxido de carbono |
| Carbón | Aceite | Helio |
Conclusión
La clasificación de elementos químicos según su estado físico es una forma útil de entender las propiedades físicas de los elementos y cómo pueden cambiar en diferentes condiciones. Los sólidos tienen una forma y un volumen definidos, los líquidos tienen un volumen definido pero no una forma definida, y los gases no tienen una forma ni un volumen definidos. Cada estado físico tiene sus propias características y ejemplos de elementos que se encuentran en cada categoría.
Preguntas frecuentes
1. ¿Qué es la materia?
La materia es todo lo que ocupa espacio y tiene masa. Los elementos químicos son una forma de materia y pueden clasificarse según su estado físico.
2. ¿Qué es la energía cinética?
La energía cinética es la energía que tiene un objeto debido a su movimiento. Las moléculas de los sólidos, líquidos y gases tienen energía cinética, pero su cantidad y velocidad varían según el estado físico.
3. ¿Pueden los elementos cambiar de estado físico sin cambios de temperatura o presión?
Sí, algunos elementos pueden cambiar de estado físico sin cambios de temperatura o presión. Por ejemplo, algunos elementos pueden sublimarse directamente del estado sólido al gaseoso sin pasar por el estado líquido.
4. ¿Qué es la presión?
La presión es la fuerza que se ejerce sobre un área determinada. En el caso de los gases, la presión se debe al impacto de las moléculas del gas contra las paredes del recipiente que lo contiene.
5. ¿Qué es la temperatura de fusión?
La temperatura de fusión es la temperatura a la que un sólido se derrite y se convierte en un líquido. Esta temperatura varía según el elemento y las condiciones en las que se encuentra.
Deja una respuesta