Bronsted y Lowry: Definición de ácidos y bases
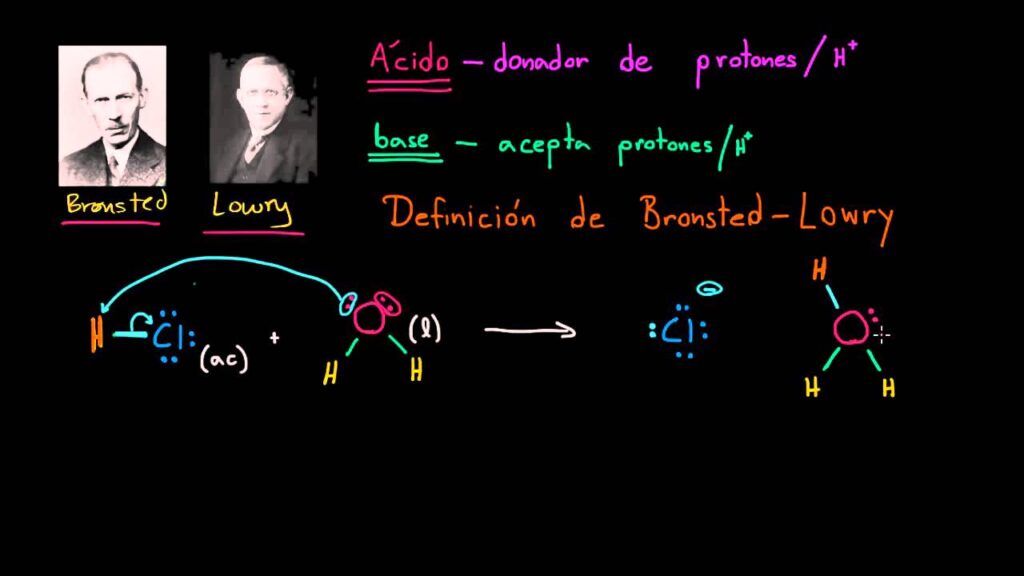
En química, es importante definir con precisión los términos ácido y base. En 1923, dos químicos, Johannes Bronsted y Thomas Lowry, propusieron una definición de ácidos y bases que aún se utiliza hoy en día. En este artículo, se explicará la definición de Bronsted-Lowry de ácidos y bases, así como su importancia en la química.
Definición de ácido y base según Bronsted-Lowry
Según la definición de Bronsted-Lowry, un ácido es una sustancia que dona un protón (un ion de hidrógeno, H+) a otra sustancia en una reacción química. Por otro lado, una base es una sustancia que acepta un protón (H+) en una reacción química. Los ácidos son sustancias que pierden protones y las bases son sustancias que ganan protones.
Por ejemplo, en la reacción entre ácido clorhídrico (HCl) y agua (H2O), el ácido clorhídrico dona un protón al agua, formando el ion hidronio (H3O+). En esta reacción, el ácido clorhídrico es el ácido y el agua es la base. La ecuación química para esta reacción es:
HCl + H2O → H3O+ + Cl-
Importancia de la definición de Bronsted-Lowry
La definición de Bronsted-Lowry es importante porque explica muchas reacciones químicas en las que se producen ácidos y bases. Por ejemplo, en la digestión, los ácidos en el estómago (ácido clorhídrico y ácido sulfúrico) ayudan a descomponer los alimentos. La definición de Bronsted-Lowry también se utiliza en la síntesis de productos químicos, la producción de energía eléctrica y la purificación de agua.
Además, la definición de Bronsted-Lowry es más amplia que otras definiciones de ácidos y bases, como la definición de Arrhenius. La definición de Arrhenius se limita a soluciones acuosas, mientras que la definición de Bronsted-Lowry se aplica a cualquier reacción química.
Ácidos y bases fuertes y débiles
Según la definición de Bronsted-Lowry, los ácidos y bases pueden ser fuertes o débiles en función de su capacidad para donar o aceptar protones. Un ácido fuerte es aquel que se disocia completamente en solución acuosa, liberando todos sus protones. Por ejemplo, el ácido clorhídrico (HCl) es un ácido fuerte porque se disocia completamente en solución acuosa, liberando iones de hidrógeno (H+).
Por otro lado, un ácido débil es aquel que se disocia parcialmente en solución acuosa, liberando solo algunos de sus protones. El ácido acético (CH3COOH) es un ejemplo de ácido débil, ya que solo se disocia parcialmente en solución acuosa.
Lo mismo ocurre con las bases. Una base fuerte es aquella que se disocia completamente en solución acuosa, aceptando todos los protones disponibles. Por ejemplo, el hidróxido de sodio (NaOH) es una base fuerte porque se disocia completamente en solución acuosa, aceptando iones de hidrógeno (H+).
Por otro lado, una base débil es aquella que se disocia parcialmente en solución acuosa, aceptando solo algunos protones. El amoníaco (NH3) es un ejemplo de base débil, ya que solo acepta protones parcialmente.
Neutralización
Cuando un ácido y una base reaccionan entre sí, se produce una reacción llamada neutralización. En esta reacción, el ácido dona un protón al ion hidroxilo (OH-) de la base, formando agua (H2O). Por ejemplo, cuando el ácido clorhídrico y el hidróxido de sodio reaccionan entre sí, se forma agua y cloruro de sodio (NaCl):
HCl + NaOH → NaCl + H2O
Esta reacción es importante en la industria alimentaria, donde se utiliza para ajustar el pH de los alimentos y bebidas.
Conclusiones
La definición de Bronsted-Lowry de ácidos y bases es una herramienta importante para comprender muchas reacciones químicas. Esta definición establece que los ácidos son sustancias que donan protones y las bases son sustancias que aceptan protones. Además, la definición de Bronsted-Lowry se aplica a cualquier reacción química, no solo a soluciones acuosas. Los ácidos y bases pueden ser fuertes o débiles en función de su capacidad para donar o aceptar protones, y cuando un ácido y una base reaccionan, se produce una neutralización.
Preguntas frecuentes
¿Qué es un ácido en química?
En química, un ácido es una sustancia que dona un protón (un ion de hidrógeno, H+) a otra sustancia en una reacción química.
¿Qué es una base en química?
En química, una base es una sustancia que acepta un protón (H+) en una reacción química.
¿Qué es un ácido fuerte?
Un ácido fuerte es aquel que se disocia completamente en solución acuosa, liberando todos sus protones.
¿Qué es una base fuerte?
Una base fuerte es aquella que se disocia completamente en solución acuosa, aceptando todos los protones disponibles.
¿Qué es la neutralización en química?
La neutralización en química es la reacción que se produce cuando un ácido y una base reaccionan entre sí, formando agua y una sal.
Deja una respuesta