Aprende a calcular el número de oxidación en compuestos
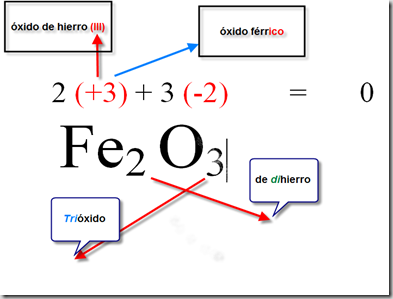
El número de oxidación es un concepto fundamental en la química, que nos permite entender la reactividad de los elementos y compuestos. El número de oxidación es la carga eléctrica que tendría un átomo si todos los electrones compartidos en un enlace covalente fueran asignados al átomo más electronegativo. En este artículo, te explicaremos cómo calcular el número de oxidación en diferentes tipos de compuestos.
- Número de oxidación en elementos
- Número de oxidación en compuestos iónicos
- Número de oxidación en compuestos covalentes
- Número de oxidación en compuestos con enlaces múltiples
- Tabla de número de oxidación común
- Conclusión
- Preguntas frecuentes
- 1. ¿Por qué es importante el número de oxidación?
- 2. ¿Cómo se determina la electronegatividad relativa de los átomos en un enlace covalente?
- 3. ¿Qué significa un número de oxidación cero?
- 4. ¿Pueden los elementos tener diferentes números de oxidación en diferentes compuestos?
- 5. ¿Cómo se comparan los números de oxidación en diferentes elementos?
Número de oxidación en elementos
En los elementos, el número de oxidación es igual a la carga que tiene el ion en su estado más estable. Por ejemplo, el número de oxidación del sodio (Na) es +1, ya que en su estado más estable pierde un electrón para formar el ion Na+.
Número de oxidación en compuestos iónicos
En los compuestos iónicos, el número de oxidación de un elemento es igual a la carga que tendría si se convirtiera en un ion. Por ejemplo, en el compuesto NaCl (cloruro de sodio), el sodio tiene un número de oxidación de +1, ya que se convierte en el ion Na+ al perder un electrón. El cloro, por otro lado, tiene un número de oxidación de -1, ya que se convierte en el ion Cl- al ganar un electrón.
Número de oxidación en compuestos covalentes
En los compuestos covalentes, el número de oxidación se determina por la electronegatividad relativa de los átomos enlazados. El átomo más electronegativo atrae los electrones compartidos con mayor fuerza y, por lo tanto, tiene un número de oxidación negativo. El otro átomo tiene un número de oxidación positivo. Por ejemplo, en el compuesto de agua (H2O), el oxígeno es más electronegativo que el hidrógeno, por lo que tiene un número de oxidación de -2. Los hidrógenos, por otro lado, tienen un número de oxidación de +1.
Número de oxidación en compuestos con enlaces múltiples
En los compuestos con enlaces múltiples, el número de oxidación se distribuye proporcionalmente entre los átomos enlazados. Por ejemplo, en el dióxido de carbono (CO2), el oxígeno tiene un número de oxidación de -2, mientras que cada carbono tiene un número de oxidación de +4 y -4.
Tabla de número de oxidación común
A continuación, presentamos una tabla con los números de oxidación comunes para algunos elementos:
| Elemento | Número de oxidación común |
|---|---|
| Hidrógeno (H) | +1 |
| Oxígeno (O) | -2 |
| Flúor (F) | -1 |
| Cloro (Cl) | -1, +1, +3, +5, +7 |
| Bromo (Br) | -1, +1, +3, +5 |
| Nitrógeno (N) | -3, -2, -1, +1, +2, +3, +4, +5 |
| Fósforo (P) | -3, -2, -1, +1, +2, +3, +4, +5 |
| Sodio (Na) | +1 |
| Potasio (K) | +1 |
| Calcio (Ca) | +2 |
Conclusión
El número de oxidación es un concepto clave en la química que nos permite entender la reactividad de los elementos y compuestos. En este artículo, hemos explicado cómo calcular el número de oxidación en diferentes tipos de compuestos, incluyendo elementos, compuestos iónicos, compuestos covalentes y compuestos con enlaces múltiples. También hemos proporcionado una tabla con los números de oxidación comunes para algunos elementos.
Preguntas frecuentes
1. ¿Por qué es importante el número de oxidación?
El número de oxidación es importante porque nos permite entender la reactividad de los elementos y compuestos. Por ejemplo, los elementos con números de oxidación positivos son más propensos a donar electrones, mientras que los elementos con números de oxidación negativos son más propensos a aceptar electrones.
2. ¿Cómo se determina la electronegatividad relativa de los átomos en un enlace covalente?
La electronegatividad relativa de los átomos se determina por la posición de los átomos en la tabla periódica. Los elementos más electronegativos se encuentran en la parte superior derecha de la tabla periódica, mientras que los elementos menos electronegativos se encuentran en la parte inferior izquierda.
3. ¿Qué significa un número de oxidación cero?
Un número de oxidación de cero significa que el átomo tiene una carga eléctrica neutra y no ha ganado ni perdido electrones.
4. ¿Pueden los elementos tener diferentes números de oxidación en diferentes compuestos?
Sí, los elementos pueden tener diferentes números de oxidación en diferentes compuestos. Por ejemplo, el cloro puede tener un número de oxidación de -1 en el cloruro de sodio (NaCl) y un número de oxidación de +3 en el clorato de sodio (NaClO3).
5. ¿Cómo se comparan los números de oxidación en diferentes elementos?
Los números de oxidación en diferentes elementos pueden compararse mediante la electronegatividad y la posición en la tabla periódica. Los elementos más electronegativos tienen números de oxidación negativos, mientras que los elementos menos electronegativos tienen números de oxidación positivos. Además, los elementos en la misma columna de la tabla periódica tienen números de oxidación similares.
Deja una respuesta