Acidos y Bases según Arrhenius: Fundamentos Químicos
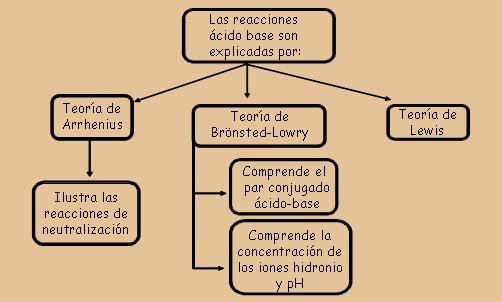
En la química, los ácidos y las bases son sustancias fundamentales que se encuentran en una gran variedad de procesos químicos, desde la digestión de los alimentos hasta la limpieza del hogar. Uno de los enfoques más comunes y conocidos para la clasificación de ácidos y bases fue desarrollado por el químico sueco Svante Arrhenius. En este artículo, exploraremos los fundamentos químicos de los ácidos y bases según Arrhenius.
¿Qué son los ácidos y las bases?
Antes de profundizar en la clasificación de los ácidos y las bases según Arrhenius, es importante tener una comprensión general de lo que son estas sustancias. En términos simples, los ácidos son sustancias que liberan protones (H+) al disolverse en agua, mientras que las bases son sustancias que liberan iones hidroxilo (OH-) al disolverse en agua.
La teoría de Arrhenius
Svante Arrhenius fue un químico sueco que propuso una teoría sobre la naturaleza de los ácidos y las bases en 1884. Su teoría se basaba en la idea de que los ácidos y las bases eran sustancias que producían iones en solución acuosa. Según esta teoría, un ácido es una sustancia que produce iones de hidrógeno (H+) cuando se disuelve en agua, mientras que una base es una sustancia que produce iones hidroxilo (OH-) cuando se disuelve en agua.
Ácidos según Arrhenius
Los ácidos según Arrhenius son sustancias que producen iones H+ en solución acuosa. Cuando un ácido se disuelve en agua, libera protones (H+) que se combinan con las moléculas de agua para formar iones hidronio (H3O+). Los ácidos pueden ser fuertes o débiles, dependiendo de cuántos protones liberen al disolverse en agua.
Ejemplos de ácidos según Arrhenius
- Ácido clorhídrico (HCl)
- Ácido sulfúrico (H2SO4)
- Ácido nítrico (HNO3)
- Ácido acético (CH3COOH)
Bases según Arrhenius
Las bases según Arrhenius son sustancias que producen iones hidroxilo (OH-) en solución acuosa. Cuando una base se disuelve en agua, libera iones hidroxilo (OH-) que se combinan con los iones hidronio (H3O+) presentes en la solución para formar moléculas de agua. Las bases también pueden ser fuertes o débiles, dependiendo de cuántos iones hidroxilo liberen al disolverse en agua.
Ejemplos de bases según Arrhenius
- Hidróxido de sodio (NaOH)
- Hidróxido de potasio (KOH)
- Hidróxido de calcio (Ca(OH)2)
- Hidróxido de amonio (NH4OH)
Reacciones ácido-base según Arrhenius
Las reacciones ácido-base son procesos químicos que implican la transferencia de protones de un ácido a una base. Según la teoría de Arrhenius, las reacciones ácido-base implican la combinación de iones hidrógeno (H+) y iones hidroxilo (OH-) para formar moléculas de agua. Este proceso se conoce como neutralización.
Ejemplo de una reacción ácido-base según Arrhenius
Ácido clorhídrico (HCl) + hidróxido de sodio (NaOH) → cloruro de sodio (NaCl) + agua (H2O)
En esta reacción, el ácido clorhídrico (HCl) reacciona con el hidróxido de sodio (NaOH) para formar cloruro de sodio (NaCl) y agua (H2O). La reacción se produce porque los iones hidrógeno (H+) del ácido reaccionan con los iones hidroxilo (OH-) de la base para formar agua.
Limitaciones de la teoría de Arrhenius
Aunque la teoría de Arrhenius proporciona una comprensión útil de la naturaleza de los ácidos y las bases, también tiene algunas limitaciones. Una de las principales limitaciones es que solo se aplica a sustancias que se disuelven en agua. Además, la teoría de Arrhenius no puede explicar completamente el comportamiento de los ácidos y las bases en soluciones no acuosas.
Conclusión
La teoría de Arrhenius proporciona una comprensión fundamental de la naturaleza de los ácidos y las bases. Según esta teoría, los ácidos son sustancias que producen iones hidrógeno (H+) en solución acuosa, mientras que las bases son sustancias que producen iones hidroxilo (OH-) en solución acuosa. Las reacciones ácido-base implican la transferencia de protones de un ácido a una base, lo que resulta en la formación de moléculas de agua. Aunque la teoría de Arrhenius tiene algunas limitaciones, sigue siendo un enfoque útil para la clasificación de ácidos y bases.
Preguntas frecuentes
¿Qué es un ácido según Arrhenius?
Según la teoría de Arrhenius, un ácido es una sustancia que produce iones hidrógeno (H+) en solución acuosa.
¿Qué es una base según Arrhenius?
Según la teoría de Arrhenius, una base es una sustancia que produce iones hidroxilo (OH-) en solución acuosa.
¿Qué es una reacción ácido-base según Arrhenius?
Una reacción ácido-base según Arrhenius implica la transferencia de protones de un ácido a una base, lo que resulta en la formación de moléculas de agua.
¿Qué es la neutralización según Arrhenius?
Según la teoría de Arrhenius, la neutralización es el proceso en el que los iones hidrógeno (H+) y los iones hidroxilo (OH-) se combinan para formar moléculas de agua.
¿Cuáles son las limitaciones de la teoría de Arrhenius?
Una de las principales limitaciones de la teoría de Arrhenius es que solo se aplica a sustancias que se disuelven en agua. Además, la teoría de Arrhenius no puede explicar completamente el comportamiento de los ácidos y las bases en soluciones no acuosas.
Deja una respuesta