Ácido y base según Bronsted-Lowry: ¡Descubre su definición!
¿Qué es un ácido y una base según Bronsted-Lowry? Esta es una de las preguntas más comunes en química, y por lo tanto, vamos a profundizar en este tema para que puedas comprenderlo de manera clara y sencilla.
Para empezar, es importante entender que la definición de ácido y base según Bronsted-Lowry es una de las más populares y utilizadas en el mundo de la química. Esta definición fue propuesta por dos químicos, J.N. Bronsted y T.M. Lowry, en el año 1923.
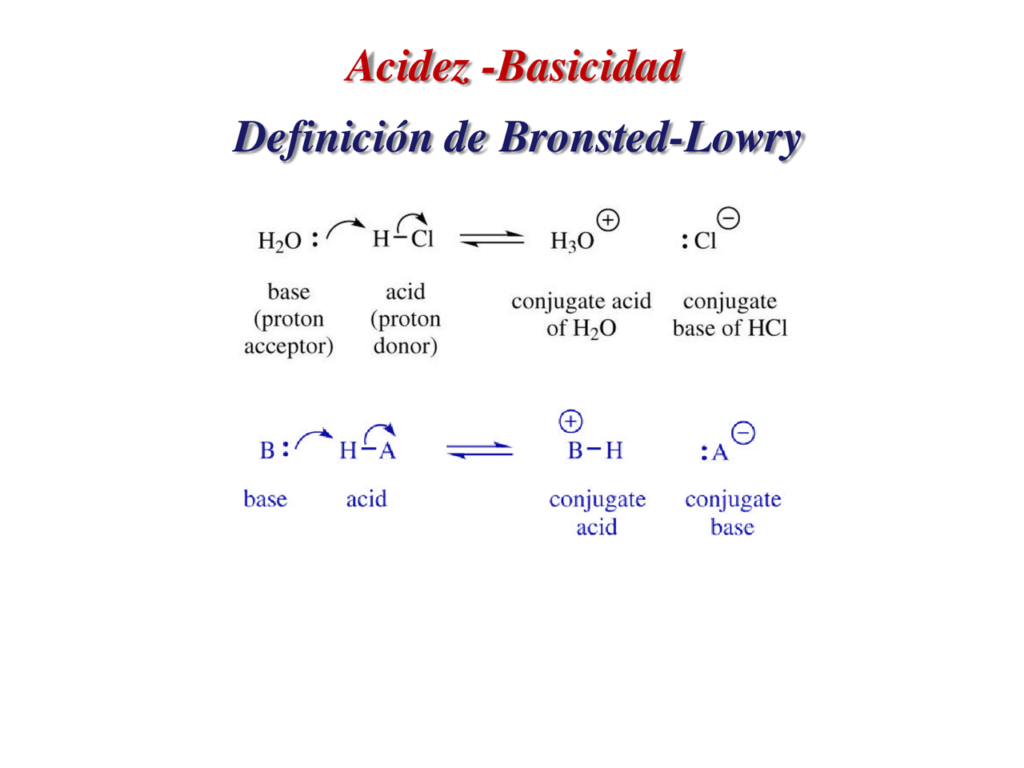
Según su definición, un ácido es una sustancia que dona un protón (H+) y una base es una sustancia que acepta un protón (H+). Es decir, un ácido es una especie química que pierde un hidrógeno, mientras que una base es una especie química que gana un hidrógeno.
Para entender mejor esta definición, podemos utilizar una analogía con una competencia de relevos. En este caso, el ácido es el corredor que pasa el testigo (el protón) al siguiente corredor, que es la base. El ácido pierde el protón y la base lo gana. De esta manera, el ácido se convierte en su forma conjugada (es decir, la forma que queda después de perder el protón) y la base se convierte en su forma conjugada (la forma que queda después de ganar el protón).
Otra forma de entender la definición de ácido y base según Bronsted-Lowry es a través de una tabla de ejemplos. A continuación, se presentan algunos ejemplos de ácidos y bases según esta definición:
| Ácido | Base |
|-------|------|
| HCl | NH3 |
| H2SO4 | OH- |
| HNO3 | H2O |
En la tabla anterior, los ácidos donan un protón (H+) y las bases aceptan un protón (H+). Por ejemplo, el ácido clorhídrico (HCl) dona un protón al agua (H2O), produciendo iones hidronio (H3O+) y cloruro (Cl-). Por otro lado, la base amoníaco (NH3) acepta un protón del agua (H2O), produciendo iones hidróxido (OH-) y amonio (NH4+).
La definición de ácido y base según Bronsted-Lowry es una de las más utilizadas en química y se basa en la capacidad de una sustancia para donar o aceptar un protón. Esta definición es fundamental para entender muchos procesos químicos, como la reacción ácido-base, la formación de sales y la estabilidad de los compuestos orgánicos e inorgánicos.
- ¿Cuál es la diferencia entre ácido y base de acuerdo a Bronsted-Lowry?
- ¿Cómo se identifican los ácidos y bases según Bronsted-Lowry?
- ¿Cuáles son las propiedades de los ácidos y bases según Bronsted-Lowry?
- ¿Cómo se pueden neutralizar los ácidos y bases según Bronsted-Lowry?
- ¿Qué es la constante de disociación ácida y base según Bronsted-Lowry?
¿Cuál es la diferencia entre ácido y base de acuerdo a Bronsted-Lowry?
La diferencia principal entre ácido y base de acuerdo a Bronsted-Lowry es que los ácidos son especies químicas que donan un protón (H+), mientras que las bases son especies químicas que aceptan un protón (H+). Es decir, los ácidos pierden un hidrógeno y las bases ganan un hidrógeno.
Además, los ácidos y las bases están relacionados entre sí por su forma conjugada. Después de que un ácido pierde un protón, se convierte en su forma conjugada, que es una base. Por otro lado, después de que una base acepta un protón, se convierte en su forma conjugada, que es un ácido.
¿Cómo se identifican los ácidos y bases según Bronsted-Lowry?
Para identificar ácidos y bases según Bronsted-Lowry, es necesario entender la definición de ácido y base de acuerdo a esta teoría. Es decir, los ácidos son especies químicas que donan un protón (H+) y las bases son especies químicas que aceptan un protón (H+).
En general, los ácidos se caracterizan por tener un hidrógeno unido a un elemento altamente electronegativo, como el cloro (Cl), el oxígeno (O) o el nitrógeno (N). Por otro lado, las bases se caracterizan por tener un par de electrones libres que pueden aceptar un protón.
Algunos ejemplos comunes de ácidos son el ácido clorhídrico (HCl), el ácido sulfúrico (H2SO4) y el ácido nítrico (HNO3). Algunos ejemplos comunes de bases son la hidróxido de sodio (NaOH), el hidróxido de potasio (KOH) y el amoníaco (NH3).
¿Cuáles son las propiedades de los ácidos y bases según Bronsted-Lowry?
Los ácidos y bases según Bronsted-Lowry tienen diferentes propiedades físicas y químicas que se relacionan con su capacidad para donar o aceptar un protón. Algunas de las propiedades de los ácidos y bases son las siguientes:
Propiedades de los ácidos:
- Son sustancias corrosivas que pueden dañar la piel y los ojos.
- Tienen un sabor agrio o ácido.
- Cambian el color de los indicadores ácido-base, como el papel tornasol.
- Reaccionan con las bases para formar sales y agua.
- Pueden disolver metales y producir gas hidrógeno (H2).
Propiedades de las bases:
- Son sustancias cáusticas que pueden dañar la piel y los ojos.
- Tienen un sabor amargo o jabonoso.
- Cambian el color de los indicadores ácido-base, como el papel tornasol.
- Reaccionan con los ácidos para formar sales y agua.
- Pueden disolver grasas y aceites.
¿Cómo se pueden neutralizar los ácidos y bases según Bronsted-Lowry?
Los ácidos y bases según Bronsted-Lowry se pueden neutralizar mediante una reacción ácido-base. En esta reacción, un ácido y una base se combinan para formar una sal y agua. La sal es un compuesto neutro que no tiene propiedades ácidas ni básicas.
Para neutralizar un ácido con una base, se necesita agregar la cantidad adecuada de base para reaccionar con todo el ácido. Esto se puede calcular utilizando la estequiometría de la reacción ácido-base. Por ejemplo, para neutralizar 1 mol de ácido clorhídrico (HCl) se necesita agregar 1 mol de hidróxido de sodio (NaOH).
Por otro lado, para neutralizar una base con un ácido, se necesita agregar la cantidad adecuada de ácido para reaccionar con toda la base. El cálculo de la cantidad de ácido necesaria se hace de la misma manera que para la neutralización de un ácido con una base.
¿Qué es la constante de disociación ácida y base según Bronsted-Lowry?
La constante de disociación ácida y base según Bronsted-Lowry es una medida de la fuerza de un ácido o una base. Esta constante se representa por Ka para ácidos y Kb para bases.
La
Deja una respuesta