Transformación de la materia: reacciones químicas explicadas
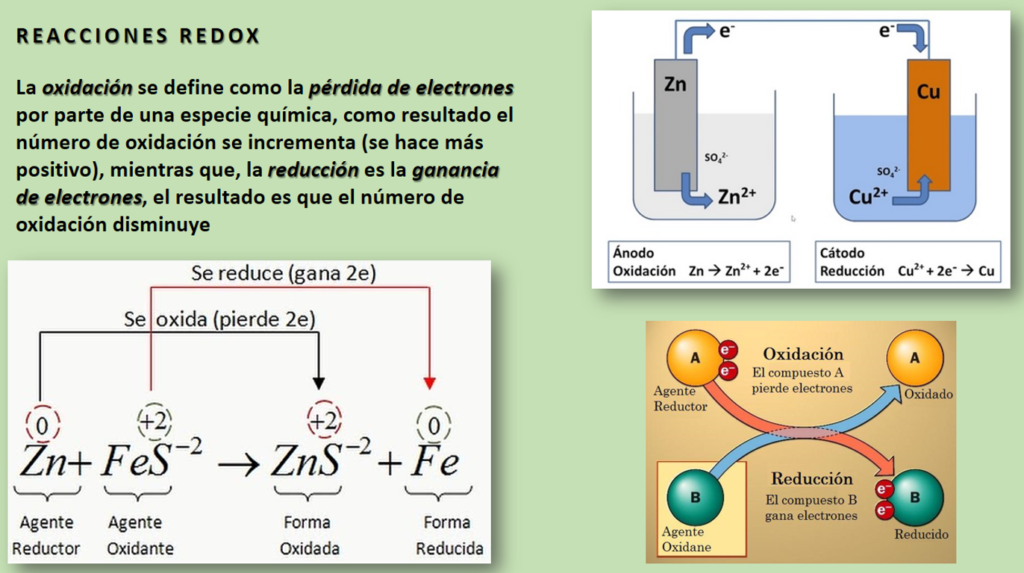
La transformación de la materia es un concepto fundamental en la química. La materia está en constante cambio, y las reacciones químicas son el proceso por el cual se producen estos cambios. En este artículo, vamos a explorar los conceptos básicos de las reacciones químicas y cómo se pueden explicar a través de analogías y ejemplos prácticos.
¿Qué son las reacciones químicas?
Las reacciones químicas son procesos en los que se forman nuevas sustancias a partir de otras. Estas nuevas sustancias tienen propiedades diferentes a las sustancias originales, lo que significa que la materia ha sido transformada. Las reacciones químicas se producen cuando los átomos se reorganizan para formar nuevas moléculas.
Las reacciones químicas y las recetas de cocina
Una forma de entender las reacciones químicas es compararlas con las recetas de cocina. En una receta de cocina, se combinan diferentes ingredientes en una cierta cantidad y se cocinan a una temperatura específica durante un tiempo determinado. El resultado final es un plato delicioso y único.
De manera similar, en una reacción química, se combinan diferentes sustancias en una cierta cantidad y se someten a ciertas condiciones, como la temperatura y la presión. El resultado final es una nueva sustancia con propiedades diferentes a las sustancias originales.
Los ingredientes de las reacciones químicas
En las reacciones químicas, los ingredientes se llaman reactivos. Los reactivos son las sustancias que se combinan para formar una nueva sustancia. Cada reactivo tiene una fórmula química única que describe su composición.
Por ejemplo, el agua tiene una fórmula química de H2O, lo que significa que está compuesta por dos átomos de hidrógeno y un átomo de oxígeno. El dióxido de carbono tiene una fórmula química de CO2, lo que significa que está compuesto por un átomo de carbono y dos átomos de oxígeno.
Las flechas de las reacciones químicas
Para representar una reacción química, se usa una fórmula química que muestra los reactivos y los productos. Los reactivos se colocan a la izquierda de una flecha, y los productos se colocan a la derecha de la flecha.
La flecha representa la transformación de los reactivos en productos. En otras palabras, los reactivos se convierten en productos a través de la reacción química.
Por ejemplo, la reacción química entre el hidrógeno y el oxígeno para formar agua se puede representar de la siguiente manera:
2H2 + O2 → 2H2O
Esto significa que dos moléculas de hidrógeno (H2) y una molécula de oxígeno (O2) reaccionan para formar dos moléculas de agua (H2O).
Tipos de reacciones químicas
Existen varios tipos diferentes de reacciones químicas, cada una con sus propias características y procesos. Aquí hay algunos de los tipos más comunes:
Reacciones de combinación
En las reacciones de combinación, dos o más reactivos se combinan para formar un producto. Esto se puede representar de la siguiente manera:
A + B → AB
Un ejemplo de una reacción de combinación es la formación de cloruro de sodio (sal de mesa) a partir del cloro y el sodio:
2Na + Cl2 → 2NaCl
Reacciones de descomposición
En las reacciones de descomposición, una sustancia se descompone en dos o más productos. Esto se puede representar de la siguiente manera:
AB → A + B
Un ejemplo de una reacción de descomposición es la descomposición del peróxido de hidrógeno en agua y oxígeno:
2H2O2 → 2H2O + O2
Reacciones de sustitución simple
En las reacciones de sustitución simple, un elemento reemplaza a otro en un compuesto. Esto se puede representar de la siguiente manera:
A + BC → AC + B
Un ejemplo de una reacción de sustitución simple es la reacción del hierro con el ácido clorhídrico para formar cloruro de hierro y gas hidrógeno:
Fe + 2HCl → FeCl2 + H2
Reacciones de sustitución doble
En las reacciones de sustitución doble, dos compuestos intercambian elementos para formar dos nuevos compuestos. Esto se puede representar de la siguiente manera:
AB + CD → AD + CB
Un ejemplo de una reacción de sustitución doble es la reacción del nitrato de plata con cloruro de sodio para formar cloruro de plata y nitrato de sodio:
AgNO3 + NaCl → AgCl + NaNO3
Conclusión
Las reacciones químicas son un proceso fundamental en la transformación de la materia. A través de analogías como las recetas de cocina y ejemplos prácticos, podemos entender cómo los reactivos se combinan para formar nuevos productos con propiedades diferentes a las sustancias originales. Con una comprensión de los diferentes tipos de reacciones químicas, podemos entender cómo se producen estos cambios y cómo se pueden aplicar en la vida cotidiana.
Preguntas frecuentes
1. ¿Qué es un reactivo?
Un reactivo es una sustancia que se combina con otra sustancia en una reacción química para formar un nuevo producto.
2. ¿Qué es una fórmula química?
Una fórmula química es una representación de la composición de una sustancia utilizando símbolos químicos y números subíndices.
3. ¿Qué es una reacción de combinación?
Una reacción de combinación es un tipo de reacción química en la que dos o más reactivos se combinan para formar un producto.
4. ¿Qué es una reacción de descomposición?
Una reacción de descomposición es un tipo de reacción química en la que una sustancia se descompone en dos o más productos.
5. ¿Qué es una reacción de sustitución doble?
Una reacción de sustitución doble es un tipo de reacción química en la que dos compuestos intercambian elementos para formar dos nuevos compuestos.
Deja una respuesta