Descubre las diferencias entre los alotropos del oxígeno
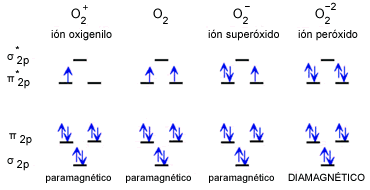
El oxígeno es un elemento químico esencial para la vida, pero lo que quizás no sabías es que existen diferentes formas en las que se puede presentar. Estas formas son conocidas como alotropos del oxígeno, y en este artículo te contaremos las diferencias entre ellos.
¿Qué son los alotropos del oxígeno?
Los alotropos del oxígeno son diferentes formas en las que este elemento puede presentarse en la naturaleza, dependiendo de las condiciones en las que se encuentre. En condiciones normales, el oxígeno se presenta en forma de gas diatómico (O2), pero bajo ciertas condiciones puede presentarse en otras formas.
Alotropos del oxígeno
Oxígeno molecular (O2)
Como ya mencionamos, esta es la forma más común en la que se presenta el oxígeno en la atmósfera. El oxígeno molecular es un gas diatómico, lo que significa que se compone de dos átomos de oxígeno unidos por un enlace covalente. Este enlace es muy fuerte, lo que hace que el oxígeno molecular sea muy estable.
Ozono (O3)
El ozono es una forma alotrópica del oxígeno que se forma cuando el oxígeno molecular se expone a una energía suficientemente alta, como la radiación ultravioleta. El ozono se compone de tres átomos de oxígeno unidos por enlaces covalentes, lo que lo hace menos estable que el oxígeno molecular.
Oxígeno atómico (O)
El oxígeno atómico es una forma alotrópica del oxígeno que se forma cuando el oxígeno molecular se expone a una energía suficientemente alta para romper el enlace covalente que une los dos átomos. El oxígeno atómico es muy reactivo y se combina fácilmente con otros elementos para formar compuestos.
Oxígeno singlete (O2)
El oxígeno singlete es una forma alotrópica del oxígeno que se forma cuando un átomo de oxígeno se combina con un electrón desapareado para formar una molécula de oxígeno con dos electrones desapareados. El oxígeno singlete es muy reactivo y se utiliza en diferentes procesos químicos, como la fotosíntesis.
Diferencias entre los alotropos del oxígeno
Las principales diferencias entre los alotropos del oxígeno se encuentran en su estructura y propiedades químicas. El oxígeno molecular es el más estable y menos reactivo de los alotropos, mientras que el oxígeno atómico y el oxígeno singlete son mucho más reactivos y propensos a formar compuestos con otros elementos.
El ozono, por su parte, tiene propiedades intermedias entre el oxígeno molecular y el oxígeno atómico. Es menos estable que el oxígeno molecular, pero más estable que el oxígeno atómico. Además, el ozono es un poderoso oxidante y tiene propiedades desinfectantes, lo que lo hace útil en diferentes aplicaciones industriales y médicas.
Aplicaciones de los alotropos del oxígeno
Los alotropos del oxígeno tienen diferentes aplicaciones en la industria y la medicina. El oxígeno molecular se utiliza para la respiración humana y la combustión de combustibles fósiles. El ozono se utiliza como desinfectante en la industria alimentaria y médica, y el oxígeno atómico se utiliza en diferentes procesos químicos, como la síntesis de compuestos orgánicos.
Conclusión
Los alotropos del oxígeno son diferentes formas en las que este elemento puede presentarse en la naturaleza, dependiendo de las condiciones en las que se encuentre. Cada alotropo tiene propiedades químicas y aplicaciones diferentes, lo que los hace útiles en diferentes campos de la industria y la medicina.
Preguntas frecuentes
1. ¿Por qué es importante conocer los alotropos del oxígeno?
Es importante conocer los alotropos del oxígeno porque cada uno tiene propiedades químicas y aplicaciones diferentes, lo que los hace útiles en diferentes campos de la industria y la medicina.
2. ¿Cómo se forma el ozono?
El ozono se forma cuando el oxígeno molecular se expone a una energía suficientemente alta, como la radiación ultravioleta.
3. ¿Cómo se utiliza el oxígeno atómico en la industria?
El oxígeno atómico se utiliza en diferentes procesos químicos, como la síntesis de compuestos orgánicos.
4. ¿Por qué el oxígeno singlete es tan reactivo?
El oxígeno singlete es tan reactivo porque tiene dos electrones desapareados en su capa externa, lo que lo hace muy propenso a reaccionar con otros elementos.
5. ¿Cuál es el alotropo del oxígeno más estable?
El alotropo del oxígeno más estable es el oxígeno molecular (O2).
Deja una respuesta