Descubre el significado del número atómico Z en la tabla periódica
La tabla periódica es una herramienta esencial para los químicos y estudiantes de química. En ella se encuentran los elementos químicos ordenados por su número atómico Z. Este número es de gran importancia, ya que es el que define la identidad de cada elemento y su posición dentro de la tabla periódica. En este artículo, descubrirás el significado del número atómico Z y su importancia en la química.
¿Qué es el número atómico Z?
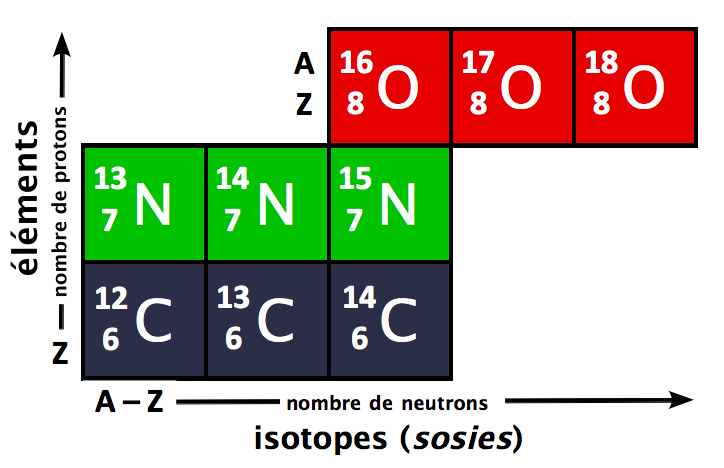
El número atómico Z de un elemento químico es el número de protones que se encuentran en el núcleo de su átomo. Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo. El número de protones determina la identidad del elemento químico, ya que cada elemento tiene un número atómico único. Por ejemplo, el hidrógeno tiene un número atómico de 1, el oxígeno tiene un número atómico de 8 y el hierro tiene un número atómico de 26.
¿Por qué es importante el número atómico Z?
El número atómico Z es importante porque determina las propiedades químicas y físicas de un elemento. Los elementos con el mismo número atómico Z tienen propiedades químicas similares y se agrupan en la misma columna de la tabla periódica, llamada grupo o familia. Por ejemplo, todos los elementos del grupo 1 de la tabla periódica (litio, sodio, potasio, etc.) tienen un solo electrón en su capa externa y reaccionan de manera similar con otros elementos.
Además, el número atómico Z también determina el número de electrones que un átomo tiene en su capa externa, lo que a su vez determina su capacidad para formar enlaces químicos con otros átomos. Los átomos con un número atómico bajo tienen menos electrones en su capa externa y tienden a perderlos para formar iones positivos, mientras que los átomos con un número atómico alto tienen más electrones en su capa externa y tienden a ganar electrones para formar iones negativos.
¿Cómo se determina el número atómico Z?
El número atómico Z se determina experimentalmente mediante espectroscopía. La espectroscopía es una técnica que utiliza la luz para estudiar la estructura y propiedades de los átomos y moléculas. Cuando se excita un átomo o molécula mediante la absorción de energía, emite radiación electromagnética en forma de luz. Cada elemento emite una luz característica con longitudes de onda específicas, que se pueden analizar para determinar el número atómico Z.
En la tabla periódica, el número atómico Z se encuentra en la parte superior de cada cuadro de elemento. También se puede encontrar el símbolo del elemento (una o dos letras) y su masa atómica, que es la suma de los protones y neutrones en el núcleo del átomo.
¿Cómo se relaciona el número atómico Z con la configuración electrónica?
La configuración electrónica de un átomo es la distribución de electrones en sus diferentes capas y subniveles de energía. La configuración electrónica de un átomo está determinada por su número atómico Z, ya que cada elemento tiene un número único de electrones.
Por ejemplo, el hidrógeno (Z = 1) tiene un solo electrón en su capa externa, que ocupa el subnivel de energía 1s. El oxígeno (Z = 8) tiene ocho electrones, dos en su capa interna y seis en su capa externa. Los primeros dos electrones se encuentran en el subnivel de energía 1s y los otros cuatro se encuentran en el subnivel de energía 2p. Cada elemento tiene una configuración electrónica única que determina sus propiedades químicas y físicas.
¿Cómo se relaciona el número atómico Z con la masa atómica?
La masa atómica de un elemento se define como la masa promedio de sus átomos. La masa atómica se expresa en unidades de masa atómica (u) y se puede encontrar en la tabla periódica junto al número atómico Z.
El número atómico Z determina la masa atómica de un elemento, ya que es la suma de los protones en el núcleo del átomo. Sin embargo, la masa atómica también incluye los neutrones en el núcleo del átomo, que pueden variar en número entre los diferentes átomos de un mismo elemento. Por lo tanto, la masa atómica de un elemento puede variar ligeramente según la presencia de isótopos (átomos con el mismo número atómico pero diferente número de neutrones).
Conclusión
El número atómico Z es una propiedad fundamental de los elementos químicos. Determina la identidad del elemento, su posición en la tabla periódica, su configuración electrónica, su capacidad para formar enlaces químicos y sus propiedades físicas y químicas. La espectroscopía es la técnica utilizada para determinar el número atómico de los elementos. La tabla periódica es una herramienta esencial para entender la química y el número atómico Z es una de sus propiedades más importantes.
Preguntas frecuentes
1. ¿Por qué se llama número atómico?
El número atómico se llama así porque es una propiedad fundamental de los átomos. Es el número de protones en el núcleo del átomo y determina la identidad del elemento.
2. ¿Por qué es importante el número atómico en la química?
El número atómico es importante en la química porque determina las propiedades químicas y físicas de un elemento. Los elementos con el mismo número atómico tienen propiedades similares y se agrupan en la misma columna de la tabla periódica.
3. ¿Cómo se determina el número atómico de un elemento?
El número atómico se determina experimentalmente mediante espectroscopía. La espectroscopía utiliza la luz para estudiar la estructura y propiedades de los átomos y moléculas.
4. ¿Cómo se relaciona el número atómico con la configuración electrónica?
El número atómico determina la configuración electrónica de un átomo, que es la distribución de electrones en sus diferentes capas y subniveles de energía.
5. ¿Cómo se relaciona el número atómico con la masa atómica?
El número atómico es la suma de los protones en el núcleo del átomo y determina la masa atómica del elemento. Sin embargo, la masa atómica también incluye los neutrones en el núcleo del átomo, que pueden variar en número entre los diferentes átomos de un mismo elemento.
Deja una respuesta