Descubre la distribución de electrones en la nube electrónica
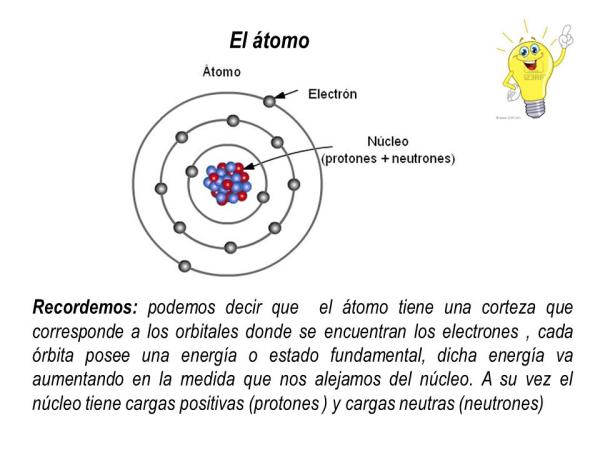
Cuando hablamos de átomos, la mayoría de las personas piensan en una pequeña esfera con un núcleo en el centro y electrones orbitando alrededor. Sin embargo, esta imagen simplificada no refleja la realidad de la distribución de electrones en la nube electrónica. En este artículo, exploraremos cómo se distribuyen los electrones en la nube electrónica y cómo esto afecta la química y la física de los átomos.
¿Qué es la nube electrónica?
Antes de profundizar en la distribución de los electrones en la nube electrónica, es importante entender qué es la nube electrónica. La nube electrónica es la región alrededor del núcleo donde es más probable que se encuentren los electrones. A diferencia de las órbitas circulares que solemos imaginar, la nube electrónica tiene una forma más compleja y se extiende a lo largo de todo el átomo.
¿Cómo se distribuyen los electrones en la nube electrónica?
La distribución de los electrones en la nube electrónica se rige por el principio de incertidumbre de Heisenberg. Este principio establece que no podemos conocer simultáneamente la posición y la velocidad de un electrón con precisión absoluta. En cambio, solo podemos conocer la probabilidad de encontrar un electrón en una determinada región de la nube electrónica.
Para describir esta probabilidad, los químicos utilizan funciones de onda matemáticas. Estas funciones de onda tienen formas específicas que corresponden a diferentes niveles de energía y subniveles dentro del átomo. Por ejemplo, un electrón en un átomo de hidrógeno puede estar en el nivel de energía 1 y en el subnivel s, que tiene una forma esférica alrededor del núcleo.
Niveles de energía
Los niveles de energía en un átomo se numeran desde el núcleo hacia el exterior. El nivel de energía más cercano al núcleo es el nivel 1, seguido del nivel 2, el nivel 3 y así sucesivamente. A medida que el número de nivel de energía aumenta, la distancia promedio del electrón al núcleo también aumenta.
Subniveles
Cada nivel de energía se divide en subniveles, que se denotan con letras: s, p, d y f. Los subniveles s tienen forma esférica alrededor del núcleo, mientras que los subniveles p tienen forma de dos lóbulos que se extienden a lo largo de los ejes x, y y z. Los subniveles d y f tienen formas más complejas y se describen mediante funciones de onda más complicadas.
Orbitales
Los orbitales son regiones específicas dentro de un subnivel donde es más probable que se encuentren los electrones. Por ejemplo, el subnivel p tiene tres orbitales: px, py y pz. Cada uno de estos orbitales se encuentra en un plano diferente y tiene una forma de dos lóbulos.
Números cuánticos
Para describir completamente la distribución de electrones en un átomo, se utilizan cuatro números cuánticos: n, l, m y s. El número cuántico principal (n) indica el nivel de energía del electrón, el número cuántico secundario (l) indica el subnivel, el número cuántico magnético (m) indica el orbital y el número cuántico de espín (s) indica la dirección del espín del electrón.
¿Cómo afecta la distribución de electrones a la química y la física de los átomos?
La distribución de electrones en la nube electrónica afecta la química y la física de los átomos de varias maneras. Por ejemplo, la forma de los orbitales determina la forma de las moléculas que se forman cuando los átomos se unen en enlaces químicos. Además, la distribución de electrones influye en la capacidad de un átomo para ganar o perder electrones y formar iones cargados.
Enlaces químicos
Cuando dos átomos se unen para formar una molécula, los electrones en sus nubes electrónicas interactúan para formar enlaces químicos. La forma de los orbitales influye en la dirección y la fuerza de estas interacciones. Por ejemplo, los orbitales p pueden solaparse para formar enlaces pi, que son más débiles que los enlaces sigma formados por los orbitales s.
Iones
La distribución de electrones también influye en la capacidad de un átomo para ganar o perder electrones y formar iones. Los átomos con una sola capa de electrones en el nivel de energía más externo (como los elementos del grupo 1 de la tabla periódica) tienen una alta tendencia a perder un electrón y formar iones positivos. Por otro lado, los átomos con una capa de electrones casi completa (como los elementos del grupo 17 de la tabla periódica) tienen una alta tendencia a ganar un electrón y formar iones negativos.
Conclusión
La distribución de electrones en la nube electrónica es una parte fundamental de la química y la física de los átomos. A través de los niveles de energía, subniveles, orbitales y números cuánticos, podemos describir la probabilidad de encontrar un electrón en una determinada región del átomo. Esta distribución de electrones influye en la forma de las moléculas, la capacidad de los átomos para formar iones y muchas otras propiedades químicas y físicas.
Preguntas frecuentes
1. ¿Por qué se llama "nube electrónica"?
La nube electrónica se llama así porque es una región del átomo donde es más probable que se encuentren los electrones. A diferencia de las órbitas circulares que solemos imaginar, la nube electrónica tiene una forma más compleja y se extiende a lo largo de todo el átomo.
2. ¿Por qué los orbitales tienen formas específicas?
Los orbitales tienen formas específicas debido a la forma en que los electrones interactúan entre sí y con el núcleo del átomo. Estas interacciones se describen mediante funciones de onda matemáticas, que tienen formas específicas que corresponden a diferentes niveles de energía y subniveles dentro del átomo.
3. ¿Por qué la distribución de electrones es importante en química?
La distribución de electrones en la nube electrónica es importante en química porque influye en la forma de las moléculas, la capacidad de los átomos para formar enlaces químicos y la capacidad de los átomos para ganar o perder electrones y formar iones.
4. ¿Cómo se describen los orbitales mediante números cuánticos?
Los orbitales se describen mediante números cuánticos que indican el nivel de energía del electrón (n), el subnivel (l
Deja una respuesta