Descubre cómo se determinan los neutrones en la tabla periódica
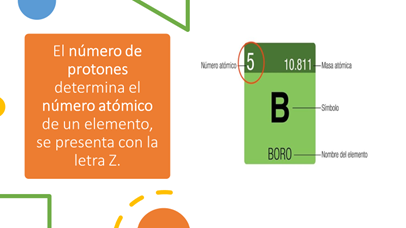
La tabla periódica es uno de los recursos más importantes de la química, ya que nos permite entender y predecir las propiedades de los elementos. Cada elemento en la tabla periódica se caracteriza por su número atómico, que es igual al número de protones en su núcleo. Sin embargo, los átomos de un mismo elemento pueden tener diferentes números de neutrones, lo que se conoce como isótopos. En este artículo, descubre cómo se determinan los neutrones en la tabla periódica.
¿Qué son los neutrones?
Antes de entrar en detalles sobre cómo se determinan los neutrones en la tabla periódica, es importante entender qué son los neutrones. Los neutrones son partículas subatómicas que se encuentran en el núcleo de los átomos, junto con los protones. A diferencia de los protones, los neutrones no tienen carga eléctrica, por lo que su presencia en el núcleo no afecta la carga eléctrica del átomo.
Cómo se determina el número de neutrones en un átomo
El número de neutrones en un átomo se puede determinar a partir del número atómico y el peso atómico del elemento. El peso atómico es la masa promedio de los isótopos de un elemento, teniendo en cuenta su abundancia relativa en la naturaleza.
Para determinar el número de neutrones en un átomo, se sigue la siguiente fórmula:
Neutrones = Peso atómico - Número atómico
Por ejemplo, el sodio tiene un número atómico de 11 y un peso atómico de 22.99. Por lo tanto, el número de neutrones en un átomo de sodio sería:
Neutrones = 22.99 - 11 = 11.99
Como el número de neutrones siempre debe ser un número entero, se redondea a 12. Por lo tanto, el sodio tiene 12 neutrones en su núcleo.
¿Por qué es importante conocer el número de neutrones?
Conocer el número de neutrones en un átomo es importante porque afecta la estabilidad del núcleo y, por lo tanto, las propiedades del elemento. Los isótopos de un elemento pueden tener diferentes propiedades físicas y químicas debido a la diferencia en el número de neutrones.
Por ejemplo, el carbono tiene tres isótopos naturales: carbono-12, carbono-13 y carbono-14. El carbono-12 y el carbono-13 son estables, mientras que el carbono-14 es radiactivo y se descompone con el tiempo. Debido a su naturaleza radiactiva, el carbono-14 se utiliza en la datación de objetos antiguos, como huesos y artefactos.
Tabla periódica y número de neutrones
En la tabla periódica, el número de neutrones no se indica directamente. En cambio, se indica el número atómico y el peso atómico del elemento. Como se mencionó anteriormente, el número de neutrones se puede determinar a partir de estos dos valores.
Además, en la tabla periódica, los elementos se agrupan según sus propiedades químicas y físicas. Los elementos en la misma columna tienen propiedades similares debido a su configuración electrónica. Sin embargo, los elementos en la misma columna pueden tener diferentes números de neutrones, lo que resulta en diferentes isótopos del elemento.
Conclusión
Los neutrones son partículas subatómicas que se encuentran en el núcleo de los átomos. El número de neutrones en un átomo se puede determinar a partir del número atómico y el peso atómico del elemento. Conocer el número de neutrones es importante porque afecta la estabilidad del núcleo y, por lo tanto, las propiedades del elemento. En la tabla periódica, el número de neutrones no se indica directamente, pero se puede determinar a partir del número atómico y el peso atómico del elemento.
Preguntas frecuentes
1. ¿Todos los elementos tienen isótopos?
Sí, todos los elementos tienen isótopos. Algunos elementos tienen isótopos estables, mientras que otros tienen isótopos radiactivos que se descomponen con el tiempo.
2. ¿Cómo se utiliza el número de neutrones en la química?
El número de neutrones afecta la estabilidad del núcleo y, por lo tanto, las propiedades del elemento. Por lo tanto, conocer el número de neutrones es importante en la química para predecir las propiedades y el comportamiento de los elementos.
3. ¿Cómo se determina el peso atómico de un elemento?
El peso atómico de un elemento se determina a partir de la masa promedio de los isótopos del elemento, teniendo en cuenta su abundancia relativa en la naturaleza.
4. ¿Cómo se representan los isótopos en la tabla periódica?
Los isótopos no se representan directamente en la tabla periódica. En cambio, se indica el número atómico y el peso atómico del elemento, a partir del cual se puede determinar el número de neutrones.
5. ¿Por qué los isótopos radiactivos son importantes en la ciencia?
Los isótopos radiactivos se utilizan en una variedad de aplicaciones científicas, como la datación de objetos antiguos, la medicina nuclear y la investigación nuclear. Los isótopos radiactivos también se utilizan en la generación de energía nuclear.
Deja una respuesta