Molécula con enlace covalente no polar: características
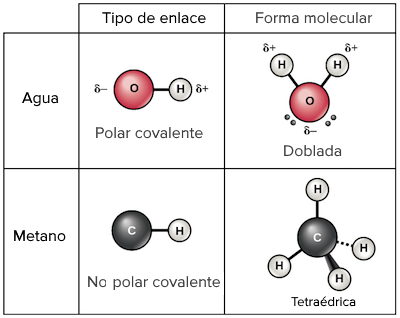
Cuando hablamos de moléculas, nos referimos a combinaciones de átomos que se unen por medio de enlaces químicos para formar una estructura estable. En algunos casos, estos enlaces son covalentes, lo que significa que los átomos comparten electrones para formar una molécula. Pero, ¿qué sucede cuando el enlace covalente no es polar?
En una molécula con enlace covalente no polar, los átomos comparten electrones de manera equitativa, lo que significa que no hay una diferencia significativa en la electronegatividad entre los átomos. En otras palabras, no hay una atracción desigual por los electrones compartidos. Como resultado, la molécula es eléctricamente neutra y no tiene una carga positiva o negativa.
A continuación, exploraremos las características de las moléculas con enlaces covalentes no polares:
- 1. Bajo punto de fusión y ebullición
- 2. Solubilidad en líquidos no polares
- 3. Insolubilidad en líquidos polares
- 4. Baja reactividad
- 5. Estabilidad térmica
- 6. Ejemplos de moléculas con enlaces covalentes no polares
- 7. Aplicaciones en la vida cotidiana
- 8. Comparación con moléculas con enlaces covalentes polares
- 9. Efectos en las propiedades físicas
- 10. Importancia en la química orgánica
1. Bajo punto de fusión y ebullición
Las moléculas con enlaces covalentes no polares tienen un bajo punto de fusión y ebullición en comparación con las moléculas con enlaces covalentes polares. Esto se debe a que las fuerzas de atracción intermoleculares son débiles en las moléculas no polares. En otras palabras, se necesita menos energía para separar las moléculas y convertirlas en líquido o gas.
2. Solubilidad en líquidos no polares
Las moléculas con enlaces covalentes no polares son solubles en líquidos no polares como el benceno, el hexano y el dióxido de carbono líquido. Esto se debe a que las moléculas no polares tienen una polaridad similar y pueden interactuar a través de fuerzas de dispersión de Van der Waals.
3. Insolubilidad en líquidos polares
Las moléculas con enlaces covalentes no polares no son solubles en líquidos polares como el agua. Esto se debe a que las moléculas polares y no polares no pueden interactuar debido a que sus fuerzas de atracción son diferentes.
4. Baja reactividad
Las moléculas con enlaces covalentes no polares tienen una baja reactividad porque los electrones están compartidos equitativamente entre los átomos. Como resultado, no hay una polaridad significativa en la molécula que pueda provocar reacciones químicas.
5. Estabilidad térmica
Las moléculas con enlaces covalentes no polares son estables térmicamente debido a la falta de polaridad. Esto significa que la molécula no se descompone fácilmente en condiciones de alta temperatura.
6. Ejemplos de moléculas con enlaces covalentes no polares
Algunos ejemplos de moléculas con enlaces covalentes no polares incluyen el oxígeno molecular (O2), el nitrógeno molecular (N2) y el dióxido de carbono (CO2).
7. Aplicaciones en la vida cotidiana
Las moléculas con enlaces covalentes no polares tienen muchas aplicaciones en la vida cotidiana. El oxígeno molecular se utiliza para apoyar la respiración en ambientes de baja concentración de oxígeno, mientras que el dióxido de carbono se utiliza en extintores de incendios. Además, el nitrógeno molecular se utiliza en la producción de amoníaco, que es un fertilizante importante.
8. Comparación con moléculas con enlaces covalentes polares
En comparación con las moléculas con enlaces covalentes polares, las moléculas con enlaces covalentes no polares tienen una menor polaridad y una menor capacidad para formar enlaces de hidrógeno. Esto significa que las moléculas no polares no pueden formar puentes de hidrógeno y tienen una menor afinidad por los solventes polares como el agua.
9. Efectos en las propiedades físicas
Los enlaces covalentes no polares tienen un efecto significativo en las propiedades físicas de la molécula. Por ejemplo, la densidad de una molécula no polar es menor que la densidad de una molécula polar debido a la falta de atracción entre las moléculas. Además, las moléculas no polares tienen un menor punto de ebullición y fusión debido a la falta de fuerzas de atracción intermoleculares.
10. Importancia en la química orgánica
Las moléculas con enlaces covalentes no polares son importantes en la química orgánica porque son comunes en los compuestos orgánicos. Los hidrocarburos, por ejemplo, son moléculas no polares que se utilizan en la producción de combustibles fósiles y otros productos químicos.
Conclusión
Las moléculas con enlaces covalentes no polares tienen características únicas que las distinguen de las moléculas con enlaces covalentes polares. Estas moléculas son importantes en la vida cotidiana y en la química orgánica debido a su baja reactividad y estabilidad térmica.
Preguntas frecuentes
1. ¿Qué es un enlace covalente no polar?
Un enlace covalente no polar es un tipo de enlace químico en el que los átomos comparten electrones de manera equitativa y no hay una atracción desigual por los electrones compartidos.
2. ¿Qué es una molécula polar?
Una molécula polar es una molécula en la que los electrones compartidos son atraídos con mayor fuerza por uno de los átomos, lo que resulta en una distribución desigual de carga eléctrica.
3. ¿Por qué las moléculas no polares son insolubles en agua?
Las moléculas no polares son insolubles en agua porque las fuerzas de atracción intermoleculares en las moléculas no polares son diferentes de las fuerzas de atracción intermoleculares en el agua, que es una molécula polar.
4. ¿Qué es un hidrocarburo?
Un hidrocarburo es un compuesto orgánico que consiste en átomos de carbono e hidrógeno. Los hidrocarburos son moléculas no polares y se utilizan en la producción de combustibles fósiles y otros productos químicos.
5. ¿Cómo afecta la polaridad al punto de fusión y ebullición de una molécula?
La polaridad afecta el punto de fusión y ebullición de una molécula porque las fuerzas de atracción intermoleculares son más fuertes en las moléculas polares que en las moléculas no polares. Como resultado, se necesita más energía para
Deja una respuesta