Rutherford vs. Bohr: Descubre las claves de sus modelos atómicos
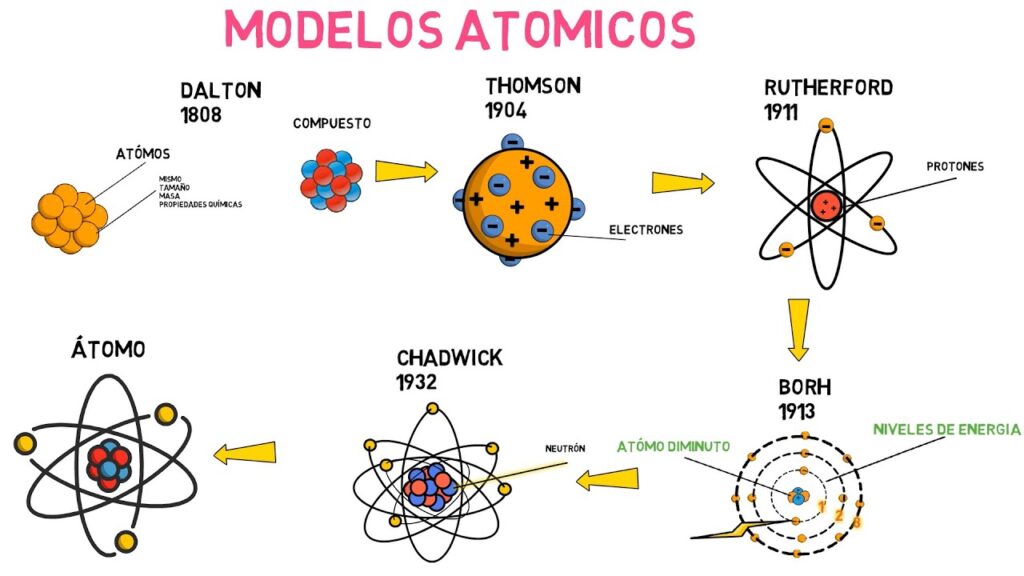
Cuando hablamos de modelos atómicos, es imposible no mencionar los nombres de Rutherford y Bohr. Ambos fueron científicos que contribuyeron de manera significativa a la comprensión de la estructura del átomo, y sus modelos aún son estudiados y enseñados en todo el mundo. En este artículo, exploraremos las claves de los modelos atómicos de Rutherford y Bohr y cómo se comparan entre sí.
- El modelo atómico de Rutherford
- El modelo atómico de Bohr
- Comparación de los modelos atómicos de Rutherford y Bohr
- Conclusión
- Preguntas frecuentes
- 1. ¿Cómo se comparan los modelos atómicos de Rutherford y Bohr?
- 2. ¿Por qué fue importante el experimento de Rutherford?
- 3. ¿Cómo explicó el modelo de Bohr la emisión y absorción de energía por parte de los electrones?
- 4. ¿Por qué es importante entender la estructura del átomo?
- 5. ¿Cómo ha evolucionado nuestro conocimiento de la estructura del átomo desde los modelos de Rutherford y Bohr?
El modelo atómico de Rutherford
Ernest Rutherford fue un físico neozelandés que, en 1911, llevó a cabo un famoso experimento que cambió nuestra comprensión del átomo. Utilizando partículas alfa, Rutherford disparó estas partículas a una lámina de oro, y observó cómo se dispersaban. Para su sorpresa, algunas de las partículas alfa fueron desviadas en ángulos muy grandes, lo que significaba que la mayor parte del átomo era espacio vacío, pero que había una masa concentrada en su centro.
Debido a estos resultados, Rutherford propuso un nuevo modelo atómico en el que el átomo tenía un núcleo denso y cargado positivamente en su centro, rodeado por electrones que orbitaban alrededor del núcleo. Este modelo se conoce como el modelo atómico de Rutherford.
Claves del modelo atómico de Rutherford
- El átomo tiene un núcleo denso y cargado positivamente en su centro.
- La mayor parte del átomo es espacio vacío.
- Los electrones orbitan alrededor del núcleo.
El modelo atómico de Bohr
Pocos años después del experimento de Rutherford, en 1913, el físico danés Niels Bohr propuso un modelo atómico que mejoraba el modelo de Rutherford. Según Bohr, los electrones no podían orbitar el núcleo en cualquier órbita, sino que se encontraban en órbitas específicas y estables. Además, Bohr argumentó que los electrones podían saltar de una órbita a otra, emitiendo o absorbiendo energía.
El modelo atómico de Bohr fue una gran contribución a la comprensión de la estructura del átomo y ayudó a explicar la emisión y absorción de luz por parte de los átomos.
Claves del modelo atómico de Bohr
- Los electrones se encuentran en órbitas específicas y estables alrededor del núcleo.
- Los electrones pueden saltar de una órbita a otra, emitiendo o absorbiendo energía.
- El modelo de Bohr ayudó a explicar la emisión y absorción de luz por parte de los átomos.
Comparación de los modelos atómicos de Rutherford y Bohr
Aunque los modelos atómicos de Rutherford y Bohr tienen algunas similitudes, también hay diferencias significativas entre ellos. Una de las principales diferencias es la forma en que los electrones orbitan el núcleo. En el modelo de Rutherford, los electrones orbitan alrededor del núcleo en cualquier órbita, mientras que en el modelo de Bohr, los electrones se encuentran en órbitas específicas y estables.
Otra diferencia importante es la explicación de la emisión y absorción de energía por parte de los electrones. En el modelo de Rutherford, no se explica cómo los electrones emiten o absorben energía, mientras que en el modelo de Bohr, se explica que los electrones saltan de una órbita a otra, emitiendo o absorbiendo energía en el proceso.
Tabla comparativa de los modelos atómicos de Rutherford y Bohr
| Modelo atómico de Rutherford | Modelo atómico de Bohr |
|---|---|
| Los electrones orbitan alrededor del núcleo en cualquier órbita. | Los electrones se encuentran en órbitas específicas y estables alrededor del núcleo. |
| No explica cómo los electrones emiten o absorben energía. | Los electrones saltan de una órbita a otra, emitiendo o absorbiendo energía en el proceso. |
Conclusión
Tanto el modelo atómico de Rutherford como el modelo atómico de Bohr son importantes para entender la estructura del átomo y el comportamiento de los electrones. El modelo de Rutherford fue el primero en proponer la existencia de un núcleo denso y cargado positivamente en el centro del átomo, mientras que el modelo de Bohr mejoró esto, explicando cómo los electrones se encuentran en órbitas específicas y estables y cómo emiten o absorben energía.
Preguntas frecuentes
1. ¿Cómo se comparan los modelos atómicos de Rutherford y Bohr?
Ambos modelos tienen similitudes, como la existencia de un núcleo denso en el centro del átomo, pero también tienen diferencias significativas. Por ejemplo, en el modelo de Rutherford, los electrones orbitan el núcleo en cualquier órbita, mientras que en el modelo de Bohr, los electrones tienen órbitas específicas y estables.
2. ¿Por qué fue importante el experimento de Rutherford?
El experimento de Rutherford fue importante porque demostró que la mayor parte del átomo era espacio vacío, pero que había una masa concentrada en el centro. Esto llevó a la propuesta del modelo atómico de Rutherford, que cambió nuestra comprensión de la estructura del átomo.
3. ¿Cómo explicó el modelo de Bohr la emisión y absorción de energía por parte de los electrones?
En el modelo de Bohr, los electrones se encuentran en órbitas específicas y estables alrededor del núcleo. Cuando un electrón salta de una órbita a otra, emite o absorbe energía en el proceso.
4. ¿Por qué es importante entender la estructura del átomo?
La comprensión de la estructura del átomo es importante porque nos permite entender cómo se combinan los átomos para formar moléculas y cómo interactúan los átomos en reacciones químicas. También es importante en campos como la física, donde el conocimiento de la estructura del átomo es esencial para entender los fenómenos cuánticos.
5. ¿Cómo ha evolucionado nuestro conocimiento de la estructura del átomo desde los modelos de Rutherford y Bohr?
Desde los modelos de Rutherford y Bohr, nuestro conocimiento de la estructura del átomo ha evolucionado significativamente. Ahora sabemos que los electrones no se encuentran en órbitas específicas, sino que se mueven en nubes de probabilidad alred
Deja una respuesta