La ley de Lavoisier: la conservación de la masa en reacciones químicas
- ¿Qué es la ley de Lavoisier?
- ¿Quién fue Lavoisier?
- ¿Cómo se aplica la ley de Lavoisier en la vida cotidiana?
- ¿Por qué es importante la ley de Lavoisier?
- ¿Cómo se puede demostrar la ley de Lavoisier?
- ¿Qué implicaciones tiene la ley de Lavoisier en la química moderna?
- ¿Qué es la conservación de la masa en una reacción química?
- ¿Cómo se puede utilizar la ley de Lavoisier para predecir los productos de una reacción química?
¿Qué es la ley de Lavoisier?
La ley de Lavoisier, también conocida como la ley de conservación de la masa, es un principio fundamental en la química que establece que la masa total de los reactivos en una reacción química es igual a la masa total de los productos obtenidos. En otras palabras, la cantidad de materia que hay antes de una reacción química debe ser igual a la cantidad de materia que hay después.
¿Quién fue Lavoisier?
Antoine Lavoisier fue un químico francés del siglo XVIII considerado el padre de la química moderna. Fue el primero en establecer la ley de conservación de la masa y también descubrió el oxígeno y acuñó el término "elemento químico".
¿Cómo se aplica la ley de Lavoisier en la vida cotidiana?
La ley de Lavoisier se aplica en muchos aspectos de la vida cotidiana, especialmente en la industria química y en la producción de alimentos. Por ejemplo, cuando se hornea un pastel, la masa total de los ingredientes utilizados debe ser igual a la masa total del pastel horneado. En la industria química, la ley de Lavoisier es esencial para la producción de productos químicos en grandes cantidades y con precisión.
¿Por qué es importante la ley de Lavoisier?
La ley de Lavoisier es importante porque es un principio fundamental que rige todas las reacciones químicas. Sin esta ley, no podríamos predecir cómo se comportarían los reactivos en una reacción química y no podríamos desarrollar nuevos productos químicos de manera segura y efectiva.
¿Cómo se puede demostrar la ley de Lavoisier?
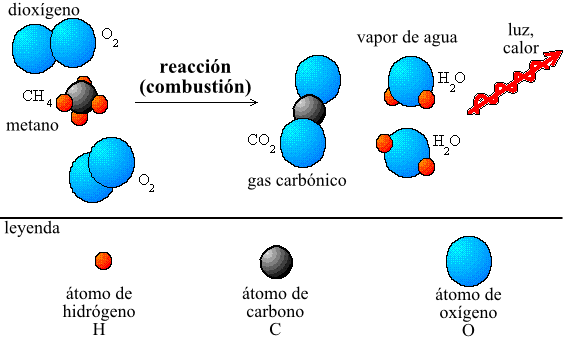
La ley de Lavoisier se puede demostrar a través de experimentos simples. Por ejemplo, si se quema una hoja de papel en una balanza cerrada, la masa total de la balanza no cambia, lo que demuestra que la masa total de los reactivos (la hoja de papel y el oxígeno del aire) es igual a la masa total de los productos (dióxido de carbono, ceniza y vapor de agua).
¿Qué implicaciones tiene la ley de Lavoisier en la química moderna?
La ley de Lavoisier sigue siendo un principio fundamental en la química moderna y ha permitido a los científicos desarrollar nuevas teorías y leyes en la química. Además, la ley de Lavoisier ha llevado al desarrollo de técnicas analíticas avanzadas que permiten a los químicos medir con precisión la cantidad de productos y reactivos en una reacción química.
¿Qué es la conservación de la masa en una reacción química?
La conservación de la masa en una reacción química significa que la masa total de los reactivos es igual a la masa total de los productos en una reacción química. Esta ley fundamental fue descubierta por Antoine Lavoisier en el siglo XVIII y es esencial para el estudio de la química moderna.
¿Cómo se puede utilizar la ley de Lavoisier para predecir los productos de una reacción química?
La ley de Lavoisier puede utilizarse para predecir los productos de una reacción química al equilibrar la ecuación química. Al equilibrar la ecuación química, se asegura que la cantidad de átomos de cada elemento se conserve en ambos lados de la ecuación. Esto permite a los químicos predecir los productos de una reacción química con precisión y desarrollar nuevas teorías y leyes en la química.
Deja una respuesta