Enlaces covalentes polares: ¿qué son y cómo identificarlos?
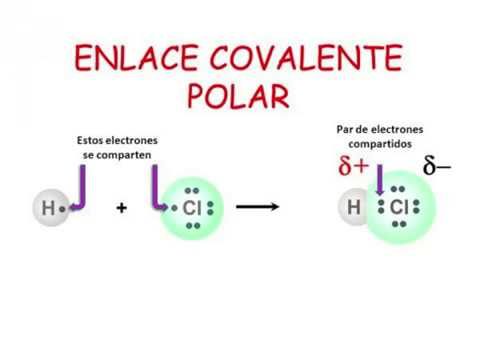
Los enlaces covalentes polares son aquellos enlaces químicos en los que los electrones no son compartidos de manera equitativa entre los átomos que forman la molécula. Esto significa que uno de los átomos tiene una mayor afinidad por los electrones que el otro, lo que da como resultado una distribución desigual de carga eléctrica en la molécula.
Cómo se forman los enlaces covalentes polares
Los enlaces covalentes polares se forman cuando dos átomos de diferentes elementos se unen y comparten un par de electrones. La electronegatividad de cada átomo determina la distribución de los electrones en el enlace. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en una molécula.
Si los dos átomos tienen electronegatividades similares, los electrones se comparten de manera equitativa y se forma un enlace covalente no polar. Sin embargo, si uno de los átomos tiene una mayor electronegatividad, este atraerá los electrones hacia sí mismo y generará una carga parcial negativa en el átomo y una carga parcial positiva en el otro átomo. Este tipo de enlace se conoce como enlace covalente polar.
Cómo identificar los enlaces covalentes polares
Para identificar si una molécula tiene enlaces covalentes polares, es necesario conocer la electronegatividad de los átomos que forman la molécula. La electronegatividad de los elementos se mide en la escala de Pauling, que varía de 0 a 4. Los elementos con electronegatividad cercana a cero son los menos electronegativos, mientras que los elementos con electronegatividad cercana a cuatro son los más electronegativos.
Si la diferencia de electronegatividad entre dos átomos es mayor a 0,4, entonces se dice que la molécula tiene enlaces covalentes polares. Si la diferencia de electronegatividad es menor a 0,4, la molécula tendrá enlaces covalentes no polares.
Ejemplos de enlaces covalentes polares
Algunos ejemplos de moléculas con enlaces covalentes polares son:
- Agua (H2O): el oxígeno es más electronegativo que el hidrógeno, por lo que la molécula de agua tiene un enlace covalente polar.
- Ácido clorhídrico (HCl): el cloro es más electronegativo que el hidrógeno, por lo que la molécula de ácido clorhídrico tiene un enlace covalente polar.
- Dióxido de carbono (CO2): el oxígeno es más electronegativo que el carbono, pero como las dos moléculas de oxígeno están equidistantes del carbono, la molécula de dióxido de carbono tiene enlaces covalentes no polares.
Características de los enlaces covalentes polares
Los enlaces covalentes polares tienen las siguientes características:
- La molécula tiene una carga neta.
- Los átomos involucrados en el enlace tienen electronegatividades diferentes.
- La molécula tiene un momento dipolar.
- La molécula es atraída por cargas opuestas.
Conclusión
Los enlaces covalentes polares son aquellos enlaces químicos en los que los electrones no son compartidos de manera equitativa entre los átomos que forman la molécula. Estos enlaces se forman cuando dos átomos de diferentes elementos se unen y comparten un par de electrones, pero la electronegatividad de cada átomo determina la distribución de los electrones en el enlace. Para identificar si una molécula tiene enlaces covalentes polares, es necesario conocer la electronegatividad de los átomos que forman la molécula.
Preguntas frecuentes
¿Cómo se mide la electronegatividad de los elementos?
La electronegatividad de los elementos se mide en la escala de Pauling, que varía de 0 a 4. Los elementos con electronegatividad cercana a cero son los menos electronegativos, mientras que los elementos con electronegatividad cercana a cuatro son los más electronegativos.
¿Qué diferencia hay entre un enlace covalente polar y uno no polar?
La diferencia entre un enlace covalente polar y uno no polar radica en la distribución de los electrones en la molécula. En un enlace covalente polar, los electrones no son compartidos de manera equitativa entre los átomos que forman la molécula, mientras que en un enlace covalente no polar los electrones se comparten de manera equitativa.
¿Qué características tienen los enlaces covalentes polares?
Los enlaces covalentes polares tienen las siguientes características: la molécula tiene una carga neta, los átomos involucrados en el enlace tienen electronegatividades diferentes, la molécula tiene un momento dipolar y la molécula es atraída por cargas opuestas.
¿Qué elementos son los más electronegativos?
Los elementos más electronegativos son el flúor, el oxígeno, el nitrógeno y el cloro.
¿Qué ejemplos de moléculas con enlaces covalentes polares existen?
Algunos ejemplos de moléculas con enlaces covalentes polares son el agua (H2O) y el ácido clorhídrico (HCl).
Deja una respuesta