Giro del electrón: número cuántico magnético
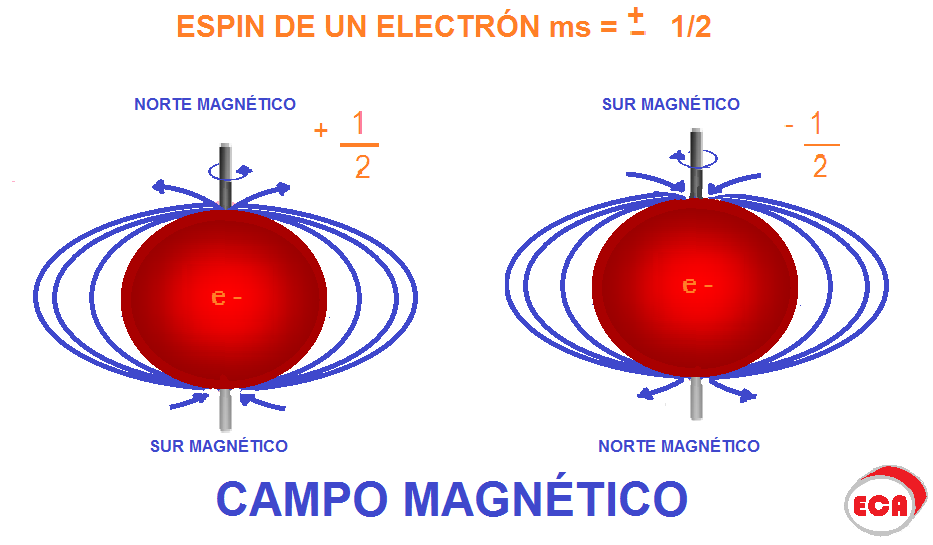
El mundo de la física cuántica es fascinante y complejo, y uno de los temas más importantes que se aborda en ella es el giro del electrón y su número cuántico magnético. Para entender estos conceptos, es necesario tener un conocimiento previo de la estructura del átomo y su comportamiento.
La estructura del átomo
El átomo está compuesto por un núcleo central que contiene protones y neutrones, y una nube de electrones que orbitan alrededor del núcleo. Los electrones tienen una carga negativa y se mantienen en su órbita gracias a la fuerza de atracción entre ellos y los protones del núcleo. La cantidad de electrones en un átomo y su distribución en las diferentes capas determinan las propiedades químicas del elemento.
El giro del electrón
El giro del electrón se refiere al movimiento de rotación que realiza alrededor de su propio eje. Este movimiento produce un campo magnético que puede ser medido y es utilizado en diferentes aplicaciones, como en la resonancia magnética nuclear.
El número cuántico magnético
El número cuántico magnético es una propiedad que se utiliza para describir el comportamiento del giro del electrón y su interacción con un campo magnético externo. Se denota por el símbolo m y puede tomar valores enteros desde -l hasta +l, donde l es el número cuántico orbital.
Ejemplo:
Si un electrón se encuentra en el orbital 2p, su número cuántico orbital es l=1. Por lo tanto, el número cuántico magnético puede tomar los valores de m=-1, 0 y +1.
La regla de Hund
La regla de Hund establece que los electrones se distribuyen en los orbitales de una misma capa con el mismo espín, antes de emparejarse con otros electrones con espines opuestos. Esto se debe a que los electrones con el mismo espín tienen una energía más baja y son más estables que los electrones con espines opuestos.
La tabla periódica y el giro del electrón
La tabla periódica es una herramienta útil para entender la distribución de los electrones en los diferentes elementos químicos. Los elementos se organizan en filas y columnas basándose en su número atómico y su configuración electrónica.
El número cuántico magnético también juega un papel importante en la determinación de la configuración electrónica de un elemento. Por ejemplo, en el caso del carbono (C), su configuración electrónica es 1s2 2s2 2p2. Esto significa que tiene dos electrones en la capa 1s, dos electrones en la capa 2s y dos electrones en la capa 2p. Los electrones del orbital 2p tienen números cuánticos magnéticos diferentes, lo que les permite tener un espín paralelo y cumplir con la regla de Hund.
Conclusión
El giro del electrón y su número cuántico magnético son conceptos fundamentales en la física cuántica y la química. Estos conceptos nos permiten entender cómo se distribuyen los electrones en los diferentes orbitales y cómo interactúan con campos magnéticos externos. La tabla periódica es una herramienta útil para visualizar y entender la configuración electrónica de los elementos químicos.
Preguntas frecuentes
1. ¿Qué es el número cuántico magnético?
El número cuántico magnético es una propiedad que describe el comportamiento del giro del electrón y su interacción con un campo magnético externo. Se denota por el símbolo m y puede tomar valores enteros desde -l hasta +l, donde l es el número cuántico orbital.
2. ¿Qué es la regla de Hund?
La regla de Hund establece que los electrones se distribuyen en los orbitales de una misma capa con el mismo espín, antes de emparejarse con otros electrones con espines opuestos. Esto se debe a que los electrones con el mismo espín tienen una energía más baja y son más estables que los electrones con espines opuestos.
3. ¿Cómo se utiliza el número cuántico magnético en la tabla periódica?
El número cuántico magnético juega un papel importante en la determinación de la configuración electrónica de un elemento. Los electrones del mismo orbital tienen números cuánticos magnéticos diferentes, lo que les permite tener un espín paralelo y cumplir con la regla de Hund.
4. ¿Qué es el espín del electrón?
El espín del electrón se refiere al momento angular intrínseco de su rotación alrededor de su propio eje. Este movimiento produce un campo magnético que puede ser medido y es utilizado en diferentes aplicaciones, como en la resonancia magnética nuclear.
5. ¿Cómo se relaciona el giro del electrón con la resonancia magnética nuclear?
El giro del electrón produce un campo magnético que puede ser medido y utilizado en la resonancia magnética nuclear. Esta técnica se basa en el hecho de que los núcleos atómicos con un número impar de protones y neutrones tienen un espín nuclear y pueden interactuar con un campo magnético externo.
Deja una respuesta