Descubre los electrones de valencia de los elementos
Si alguna vez has estudiado química, probablemente hayas oído hablar de los electrones de valencia de los elementos. Estos electrones son los responsables de la forma en que los elementos interactúan con otros elementos y moléculas. En este artículo, te explicaremos todo lo que necesitas saber sobre los electrones de valencia y cómo se utilizan para predecir la reactividad química de los elementos.
- ¿Qué son los electrones de valencia?
- Cómo encontrar los electrones de valencia de un elemento
- La importancia de los electrones de valencia en la reactividad química
- Conclusión
- Preguntas frecuentes
- ¿Qué son los electrones de valencia?
- ¿Cómo se utilizan los electrones de valencia para predecir la reactividad química de los elementos?
- ¿Por qué los elementos del grupo 1 y 2 son tan reactivos?
- ¿Cómo se utilizan los electrones de valencia para predecir la formación de enlaces químicos?
- ¿Cuál es la regla del octeto?
¿Qué son los electrones de valencia?
Los electrones de valencia son los electrones en la capa más externa del átomo. Estos electrones son los responsables de la forma en que el átomo interactúa con otros átomos y moléculas. Los electrones de valencia son importantes porque determinan la capacidad de un átomo para formar enlaces químicos con otros átomos y moléculas. En general, los átomos quieren tener ocho electrones en su capa de valencia para estar estables. Esto se conoce como la regla del octeto.
Cómo encontrar los electrones de valencia de un elemento
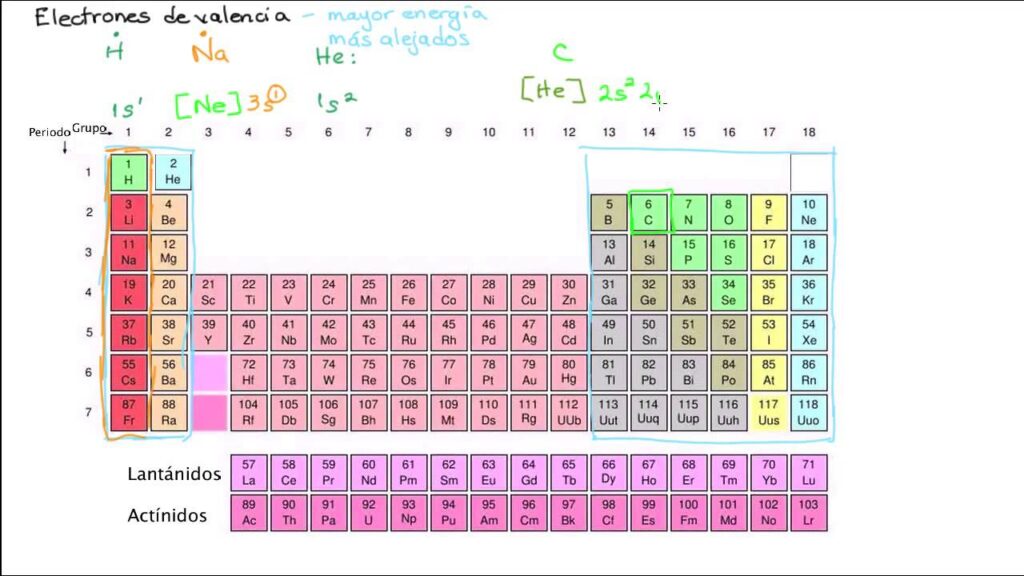
En la tabla periódica, los elementos están organizados en filas y columnas. Las filas se llaman periodos y las columnas se llaman grupos. El número de grupo al que pertenece un elemento indica el número de electrones de valencia que tiene. Por ejemplo, el carbono se encuentra en el grupo 4, lo que significa que tiene 4 electrones de valencia. El oxígeno se encuentra en el grupo 6, lo que significa que tiene 6 electrones de valencia.
La importancia de los electrones de valencia en la reactividad química
Los electrones de valencia son importantes porque determinan la capacidad de un átomo para formar enlaces químicos con otros átomos y moléculas. Los átomos con electrones de valencia incompletos son más reactivos que los átomos con electrones de valencia completos. Los átomos reactivos pueden formar enlaces con otros átomos para completar su capa de valencia y convertirse en más estables.
Los elementos de los grupos 1 y 2
Los elementos de los grupos 1 y 2 son muy reactivos porque tienen uno o dos electrones de valencia. Estos átomos tienden a perder estos electrones para formar iones positivos y así completar su capa de valencia. Los iones positivos que se forman son conocidos como cationes. Por ejemplo, el sodio (Na) tiene un electrón de valencia y tiende a perderlo para formar el catión Na+. El magnesio (Mg) tiene dos electrones de valencia y tiende a perderlos para formar el catión Mg2+.
Los elementos del grupo 3 al 12
Los elementos del grupo 3 al 12 son menos reactivos que los del grupo 1 y 2, pero aún pueden formar enlaces químicos con otros átomos. Estos elementos tienen electrones de valencia en su capa más externa, pero no tienen suficientes electrones para perderlos y completar su capa de valencia. En cambio, estos átomos tienden a compartir electrones con otros átomos para completar su capa de valencia. Los átomos que comparten electrones se unen mediante enlaces covalentes.
Los elementos del grupo 13 al 18
Los elementos del grupo 13 al 18 tienen electrones de valencia completos o casi completos. Estos elementos son menos reactivos que los del grupo 1 y 2 y tienen menos tendencia a perder o ganar electrones. En cambio, estos átomos tienden a compartir electrones para completar su capa de valencia y formar enlaces covalentes.
Conclusión
Los electrones de valencia son los electrones en la capa más externa del átomo. Estos electrones son los responsables de la forma en que los elementos interactúan con otros elementos y moléculas. Los elementos reactivos tienen electrones de valencia incompletos y tienden a formar enlaces químicos para completar su capa de valencia. Los elementos menos reactivos tienen electrones de valencia completos o casi completos y tienden a compartir electrones para completar su capa de valencia.
Preguntas frecuentes
¿Qué son los electrones de valencia?
Los electrones de valencia son los electrones en la capa más externa del átomo. Estos electrones son responsables de la forma en que los elementos interactúan con otros elementos y moléculas.
¿Cómo se utilizan los electrones de valencia para predecir la reactividad química de los elementos?
Los elementos reactivos tienen electrones de valencia incompletos y tienden a formar enlaces químicos para completar su capa de valencia. Los elementos menos reactivos tienen electrones de valencia completos o casi completos y tienden a compartir electrones para completar su capa de valencia.
¿Por qué los elementos del grupo 1 y 2 son tan reactivos?
Los elementos del grupo 1 y 2 son muy reactivos porque tienen uno o dos electrones de valencia. Estos átomos tienden a perder estos electrones para formar iones positivos y así completar su capa de valencia.
¿Cómo se utilizan los electrones de valencia para predecir la formación de enlaces químicos?
Los electrones de valencia determinan la capacidad de un átomo para formar enlaces químicos con otros átomos y moléculas. Los átomos con electrones de valencia incompletos tienden a formar enlaces para completar su capa de valencia y convertirse en más estables. Los átomos con electrones de valencia completos o casi completos tienden a compartir electrones para completar su capa de valencia y formar enlaces covalentes.
¿Cuál es la regla del octeto?
La regla del octeto establece que los átomos quieren tener ocho electrones en su capa de valencia para estar estables.
Deja una respuesta