Descubre el estado de oxidación de los elementos
El estado de oxidación de los elementos es una propiedad química fundamental que se utiliza para describir la capacidad de un átomo para ceder o aceptar electrones en una reacción química. Es importante entender el estado de oxidación de los elementos porque nos ayuda a predecir cómo se comportarán en ciertas reacciones químicas y cómo se forman los compuestos.
En este artículo, descubrirás qué es el estado de oxidación, cómo se determina y cómo se relaciona con la tabla periódica. También exploraremos algunos ejemplos de estado de oxidación y su aplicación en la vida cotidiana.
- ¿Qué es el estado de oxidación?
- ¿Cómo se determina el estado de oxidación?
- ¿Cómo se relaciona el estado de oxidación con la tabla periódica?
- Ejemplos de estado de oxidación
- Aplicaciones del estado de oxidación
- Conclusión
- Preguntas frecuentes
- ¿Cuál es la diferencia entre oxidación y reducción?
- ¿Por qué es importante el estado de oxidación en la síntesis de compuestos químicos?
- ¿Cómo se determina el estado de oxidación en los compuestos iónicos?
- ¿Por qué el oxígeno tiene un estado de oxidación de -2 en la mayoría de los compuestos?
- ¿Por qué los metales alcalinos tienen un estado de oxidación de +1?
¿Qué es el estado de oxidación?
El estado de oxidación de un elemento se refiere a la carga eléctrica que tendría un átomo si todos sus electrones fueran transferidos a los átomos más electronegativos en una molécula o compuesto. En otras palabras, es la cantidad de electrones que un átomo ha ganado o perdido en una reacción química.
El estado de oxidación se muestra con un número entero, positivo o negativo. Si el número es positivo, significa que el átomo ha perdido electrones y si el número es negativo, significa que el átomo ha ganado electrones.
¿Cómo se determina el estado de oxidación?
La determinación del estado de oxidación de un átomo se basa en las reglas establecidas en la nomenclatura de los compuestos químicos. Algunas de las reglas básicas para determinar el estado de oxidación son:
- Los elementos en estado libre tienen un estado de oxidación de cero.
- Los iones monoatómicos tienen un estado de oxidación igual a su carga.
- El hidrógeno generalmente tiene un estado de oxidación de +1, excepto cuando se combina con metales alcalinos, donde tiene un estado de oxidación de -1.
- El oxígeno generalmente tiene un estado de oxidación de -2, excepto en los peróxidos donde tiene un estado de oxidación de -1.
- Los metales alcalinos tienen un estado de oxidación de +1 y los metales alcalinotérreos tienen un estado de oxidación de +2.
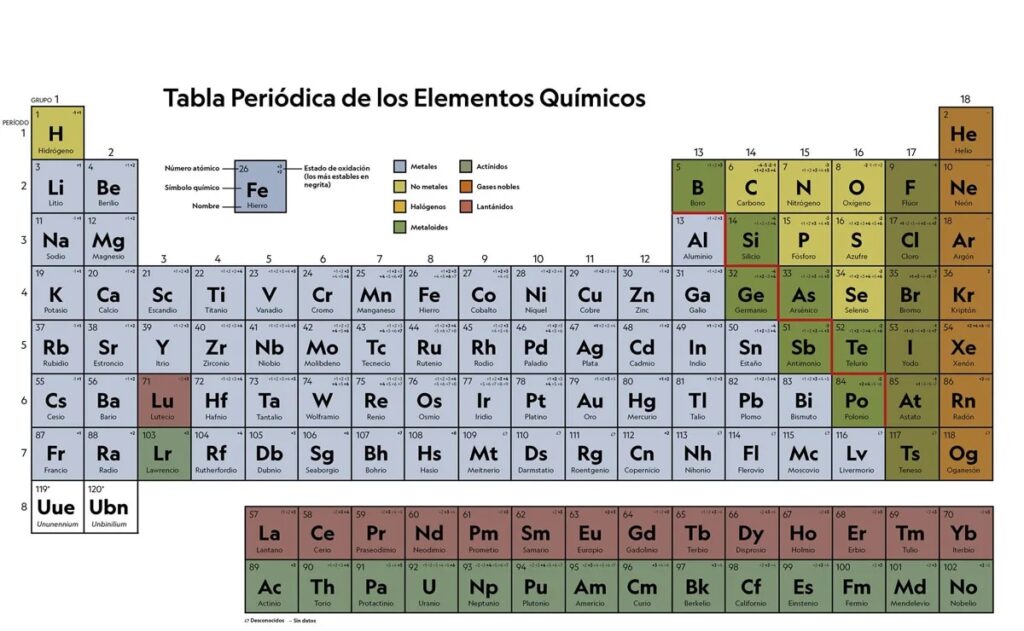
¿Cómo se relaciona el estado de oxidación con la tabla periódica?
El estado de oxidación de un elemento se relaciona con su posición en la tabla periódica. Los elementos en el grupo 1A (metales alcalinos) tienen un estado de oxidación de +1, mientras que los elementos en el grupo 2A (metales alcalinotérreos) tienen un estado de oxidación de +2.
Los elementos en el grupo 7A (halógenos) tienen un estado de oxidación de -1, mientras que los elementos en el grupo 6A (calcógenos) tienen un estado de oxidación de -2. Los halógenos son altamente electronegativos y tienden a ganar un electrón para completar su octeto, mientras que los calcógenos tienen una tendencia similar pero menos fuerte.
Ejemplos de estado de oxidación
- Ag+: El estado de oxidación de plata en el ion plata es +1.
- Fe2+: El estado de oxidación de hierro en el ion ferroso es +2.
- Cl-: El estado de oxidación de cloro en el ion cloruro es -1.
- H2O2: El estado de oxidación del oxígeno en el peróxido de hidrógeno es -1.
- SO4^2-: El estado de oxidación del azufre en el ion sulfato es +6.
Aplicaciones del estado de oxidación
El estado de oxidación tiene muchas aplicaciones prácticas en la vida cotidiana. Algunos ejemplos incluyen:
- La oxidación y reducción en la corrosión de metales.
- La determinación de la carga eléctrica en las células y tejidos biológicos.
- La identificación de iones en solución.
- La síntesis de compuestos químicos específicos.
Conclusión
El estado de oxidación es una propiedad química fundamental que se utiliza para describir la capacidad de un átomo para ceder o aceptar electrones en una reacción química. Es importante entender el estado de oxidación de los elementos porque nos ayuda a predecir cómo se comportarán en ciertas reacciones químicas y cómo se forman los compuestos. La determinación del estado de oxidación se basa en las reglas establecidas en la nomenclatura de los compuestos químicos y se relaciona con la posición de los elementos en la tabla periódica.
Preguntas frecuentes
¿Cuál es la diferencia entre oxidación y reducción?
La oxidación es la pérdida de electrones por parte de un átomo, mientras que la reducción es la ganancia de electrones por parte de un átomo. Estos procesos suelen ocurrir juntos en una reacción química y se conocen como reacciones de oxidación-reducción o redox.
¿Por qué es importante el estado de oxidación en la síntesis de compuestos químicos?
El estado de oxidación es importante en la síntesis de compuestos químicos porque nos permite predecir cómo se formarán los enlaces químicos y cómo se comportarán los átomos en una reacción. Al entender el estado de oxidación de los elementos en un compuesto, podemos elegir las condiciones adecuadas para sintetizarlo de manera eficiente.
¿Cómo se determina el estado de oxidación en los compuestos iónicos?
En los compuestos iónicos, el estado de oxidación de cada elemento se determina a partir de la carga del ion. Por ejemplo, en el cloruro de sodio (NaCl), el sodio tiene un estado de oxidación de +1 y el cloro tiene un estado de oxidación de -1.
¿Por qué el oxígeno tiene un estado de oxidación de -2 en la mayoría de los compuestos?
El oxígeno es altamente electronegativo y tiende a ganar dos electrones para completar su octeto. Por lo tanto, en la mayoría de los compuestos, tiene un estado de oxidación de -2. Sin embargo, hay algunas excepciones, como en los peróxidos donde tiene un estado de oxidación de -1.
¿Por qué los metales alcalinos tienen un estado de oxidación de +1?
Los metales alcalinos tienen solo un electrón en su capa externa, lo que significa que tienen una gran tendencia a perderlo en una reacción química. Por lo tanto, en la mayoría de los compuestos, tienen un estado de oxidación de +1.
Deja una respuesta